
| A、CO的燃烧热为566.0 kJ?mol-1 |
| B、2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C、完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
| D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ?mol-1 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
A、 |
B、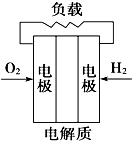 |
C、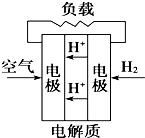 |
D、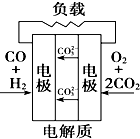 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+H2O=HCl+HClO |
| B、2F2+2H2O=4HF+O2 |
| C、Na2O+H2O=2NaOH |
| D、2Na+H2O=2NaOH+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、X、Y形成的简单离子半径大小关系为W>X>Y |
| B、M、W元素形成的简单氢化物的沸点:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3 和NaOH |
| B、Na2CO3和HCl |
| C、NaHCO3和HCl |
| D、NaAlO2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:1 | B、1:4 |
| C、4:1 | D、1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
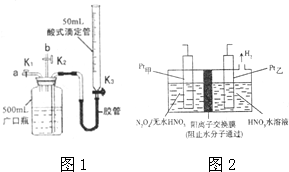
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com