
����Ŀ������VIA��Ԫ�أ��䵥�ʺͻ������ڻ��������ȷ�����й㷺��Ӧ�á�
(1)TeO2���������������ˮ��������ǿ���ǿ�TeO2��NaOH��Һ������Ӧ�����ӷ���ʽΪ_________________________________��
(2)����(H6TeO6)��һ�ֺ������ᣬKa1=1��10-7�����¶��£�0.1mol/L H6TeO6�ĵ����aΪ_____________(�������1λ��Ч����)��
(3)�Ӵ�ͭ������������(��Ҫ����Cu2Te)����ȡ���ڵ�һ�ֹ���������ͼ:

����֪��ѹ���ʱ������Һ��pHΪ5.0������TeO2���������H2SO4��ҺŨ�ȹ������ĺ����____________________________��
�ڡ���ѹ�������ΪʲôҪ��ѹ��_______________________________��
�۶��������������Na2SO3����Te(SO4)2��Һ�н��С���ԭ���õ���̬�ڣ��÷�Ӧ�����ӷ���ʽ��_________________________________��
�ܡ���ԭ���õ���̬�ں��������ڵķ�����_______���Դ��ڽ���ϴ�ӣ��ж�ϴ�Ӹɾ���ʵ�������������______________________________________��
��֪��������Cu2Te�ĺ���Ϊa%����m�������������Ͽ��Ƶô���Ϊn%�Ĵ���___�֡�
���𰸡� TeO2+2OH=TeO32-+H2O 0.1% TeO2��������ᷴӦ������TeO2��������ȫ �ӿ��ܽ����ʣ������ڷ�Ӧ������TeO2�ķ������ 2SO32-+ Te4++2H2O=Te��+2SO42-+4H+ ���� ȡ�������һ��ϴ��Һ������BaCl2��Һ����û�а�ɫ�������ɣ���˵��ϴ�Ӹɾ� ![]()
��������(1)TeO2�������������NaOH��Һ��Ӧ������Na2TeO3��ˮ��������Ӧ�����ӷ���ʽΪTeO2+2OH=TeO32-+H2O��
(2) H6TeO6![]() H5TeO6-+H+
H5TeO6-+H+
��ʼŨ��(mol/L) 0.1 0 0
�仯Ũ��(mol/L) 0.1�� 0.1�� 0.1��
ƽ��Ũ��(mol/L) 0.1(1-��) 0.1�� 0.1��
Ka1=1��10-7=[0.1����0.1��]/[0.1(1-��)]������=0.1%��
(3)��TeO2�������ԣ������Һ���Թ�ǿ��TeO2��������ᷴӦ������TeO2��������ȫ���ڼ�ѹ���Լӿ��ܽ����ʣ������ڷ�Ӧ������TeO2�ķ�����У���Na2SO3����Te(SO4)2��Һ�н��л�ԭ�õ���̬�ڣ�ͬʱ����Na2SO4���÷�Ӧ�����ӷ���ʽ�� 2SO32��+Te4+ +2H2O��Te��+2SO42��+4H+����ͨ�����˴ӷ�Ӧ��Ļ��Һ�л�ô��ڣ����ڱ��渽�ŵ������к���SO42-������ж�ϴ�Ӹɾ���ʵ������������ǣ�ȡ�������һ��ϴ��Һ������BaCl2��Һ����û�а�ɫ�������ɣ���˵��ϴ�Ӹɾ�����֪��������Cu2Te�ĺ���Ϊa%�������ԭ���غ��֪m�������������Ͽ��Ƶô���Ϊn%�Ĵ���![]() �֡�
�֡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.CH4��CO2���������ֵ���ߵĻ�ѧ��Ʒ����֪��
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ��H 1=a kJ/mol
CO2(g)+2H2O(g) ��H 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H 2=b kJ/mol
CO2(g)+H2(g) ��H 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ��H 3=c kJ/mol
2CO2(g) ��H 3=c kJ/mol
��1����ӦCH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H = kJ/mol(�ú�a��b��c�Ĵ���ʽ��ʾ)��
2CO(g)+2H2(g) ��H = kJ/mol(�ú�a��b��c�Ĵ���ʽ��ʾ)��
��2��һ�������£������ʵ����ģ�1���з�Ӧ���ɵ�����ɺϳɶ�����(CH3OCH3)��ͬʱ��������һ�ֿɲ������ѭ������������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3����Cu2Al2O4��������һ�������·�����Ӧ��CO2(g)+CH4(g)![]() CH3COOH(g)���¶�������Ĵ�Ч�ʺ�������������ʵĹ�ϵ��ͼ���ش��������⣺
CH3COOH(g)���¶�������Ĵ�Ч�ʺ�������������ʵĹ�ϵ��ͼ���ش��������⣺
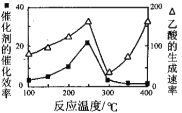
��250��300��ʱ��������������ʽ��͵�ԭ���� ��
��300��400��ʱ������������������ߵ�ԭ���� ��
��.�����������ڽ���Na������S�Ͷ�����(Na2Sx )�ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մ�(�ɴ���Na+)Ϊ����ʣ��䷴Ӧԭ����ͼ��ʾ��
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050 |
�е�/�� | 892 | 444.6 | 2980 |

��4�������ϱ����ݣ��жϸõ�ع����������¶�ӦΪ (����ĸ���)��
A��100������
B��100����300��
C��300����350��
D��350����2050��
��5�����������أ�����˵����ȷ���� (����ĸ���)��
A���ŵ�ʱ���缫AΪ����
B���ŵ�ʱ��Na+���ƶ�����Ϊ��B��A
C�����ʱ���缫AӦ���ӵ�Դ������
D�����ʱ�缫B�ĵ缫��ӦʽΪ![]() 2e
2e![]() xS
xS
��6��25��ʱ��������������Ϊ��Դ���500mL 0.2mol/L NaCl��Һ������Һ��pH��Ϊ13ʱ����·��ͨ���ĵ��ӵ����ʵ���Ϊ mol�������ķ�Ӧ���������Ϊ g��(������ǰ�����ķ�Ӧ����������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������˵���������
A. l00mL1mol/LNa2SO4��Һ��������������Ϊ0.3NA
B. �����£�22.4LH2O����10NA������
C. �����£�46gNO2��N2O4�Ļ�������к��еĵ�ԭ����ĿΪNA
D. ��120gʯī��дa���֣���ƽ��ÿ����Լ����![]() ��̼ԭ��
��̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������������ȷ���ǣ� ��
A. �����г������⣬�ܶ��ʹ����KMn04��Һ����ɫ��ȥ
B. 15g������CH3�����еĵ�������9NA
C. 7.8g���к��е�̼̼˫����Ϊ0.3NA
D. ��״���£�2.24 L CCl4�е�ԭ������Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ij�ֺ�����H2SOx(x��4)��H2S�ɷ������·�Ӧ��H2S+H2SOx��S+(x-3)SO2+H2O(δ��ƽ)�����ƶϺ�������
A. �÷�Ӧ�У�һ����SO2 B. �÷�Ӧ�У�H2S����ԭ����H2SOx��������
C. ��x=3����ԭ���������������ʵ���֮��Ϊ1:1 D. ��x=4��ÿ����1molS��ת�Ƶĵ���Ϊ6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к������������PM2.5������Ӱ���˵������ͽ�������˸��Ʒ��ʽṹ������������ʩ����Ч����PM2.5��SO2��NO3�ȵ���Ⱦ����ش��������⣺
(1)��һ������ijPM2.5��Ʒ������ˮ�ܽ��Ƴɴ�������(����OH-)�������£���ø���������ɼ���Ũ�����±���
���� | K+ | Na+ | NH4+ | SO42- | NO3�� | Cl�� |
Ũ��/mol��L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������жϣ���������pH = ________��
(2)����β����NOx��CO�����ɡ���֪������������NO�ķ�ӦΪN2(g)+O2(g)![]() 2NO(g) ��H��0�����£������ܱ������У�������������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����________ (�����)��
2NO(g) ��H��0�����£������ܱ������У�������������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����________ (�����)��
A.���������ܶȲ��ٱ仯 B.��������ƽ�������������ٱ仯
C.N2��O2��NO�����ʵ���֮��Ϊ1��1��2 D.������ת���ʲ��ٱ仯
E.����lmol N2�ļ�ʱ��lmol O2������
(3)Ϊ����CO2��SO2���ŷţ�����ȡ�Ĵ�ʩ����:
�ٽ�úת��Ϊ�[������ȼ�ϡ���֪��H2(g)+1/2O2(g)= H2O(g) ��H =-241.8kJ mol-1�� C(s)+1/2O2(g)=CO(g) ��H =-110.5kJ mol-1��д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��_____________________________________��
��ϴ�Ӻ�SO2���������������ʣ�����Ϊϴ�Ӻ�SO2������ϴ�Ӽ�����______(�����)��
A.Ũ��ˮ B.̼�����Ʊ�����Һ C.FeCl3������Һ D.����CaCl2������Һ
(4)ijʪ���£���Ӧ2NO(g)+O2(g) ![]() 2NO2(g)�У��ڱ�֤O2Ũ�Ȳ��������£��������������, ƽ�⽫_____(�����Ӧ���� ���淴Ӧ������)�ƶ���
2NO2(g)�У��ڱ�֤O2Ũ�Ȳ��������£��������������, ƽ�⽫_____(�����Ӧ���� ���淴Ӧ������)�ƶ���
�жϵ�������__________________________________��
(5)�״�ȼ�ϵ�ؿ��ܳ�Ϊδ����Я���Ӳ�ƷӦ�õ�������ij�ּ״�ȼ�ϵ�صĹ���ԭ����ͼ14��ʾ����ͨ��a����ĵ缫���缫��ӦʽΪ_________________��

(6)���������£��״���һ����̼��Ӧ���Ժϳ����ᡣ���������£���a mol/L��CH3COOH��Һ��bmol/LBa(OH)2��Һ�������ϣ���Ӧƽ��ʱ��2c(Ba2+)=c(CH3COO-)���ú�a��b�Ĵ���ʽ��ʾ���û����Һ�д���ĵ��볣��Ϊ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. ������Ԫ�ص����Ӷ���������
B. ���ö�����������������Һ�ͽ���
C. ijԪ�ش�����̬��Ϊ����̬ʱ����Ԫ�ؿ��ܱ�����
D. ͬ��ͬѹ�£���ͬ��������庬����ͬ��Ŀ�ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ԣ��ṹ��ʽ����ͼ������Ϊ������������ص�ԭ�ϣ��ܳ���������֬�����������۵�����ʹ���������㾫�С������й�������ȷ����

A. ��������������ϩ���������廯����
B. �����Է�����������9��̼ԭ�ӹ���
C. ��������H2��Br2���ܷ����ӳɷ�Ӧ
D. ������Ի�Ϊͬ���칹���Һ��������Ȼ���һ��֧���Ľṹ��3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com