
| A、将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 |
| B、在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
| C、在c(H+)/c(OH-)=l012溶液中 Na+、I-、NO3-、SO42-不能大量共存 |
| D、饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 |


科目:高中化学 来源: 题型:
| A、钢铁制品腐蚀时正极反应:O2+2H2O+4e-=4OH- |
| B、在酸性较强的溶液中,金属主要发生析氢腐蚀 |
| C、为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接 |
| D、在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝制品比铁制品在空气中更容易被腐蚀 |
| B、实验室用铜片与稀硝酸反应产生的气体可用排水法收集 |
| C、向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同 |
| D、以海水为原料能制取Na、HCl、Mg、Br2等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室配制FeCl3溶液时用盐酸溶解FeCl3固体 |
| B、向沸水中滴加饱和FeCl3溶液加热至红褐色制得Fe(OH)3胶体 |
| C、短期保存FeCl2溶液时向其中加入少量铁粉 |
| D、保存Na2CO3溶液的试剂瓶用橡胶塞而不能用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:4 | B、4:1 |
| C、1:9 | D、9:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
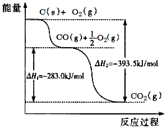
| A、48g碳完全燃烧放出热量为1574 kJ/mol |
| B、2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol |
| C、2CO2(g)═2CO(g)+O2(g)△H=+283.0kJ/mol |
| D、C(s)+O2(g)═CO2(s)△H=-393.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何纯净物都含有相同的原子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol水中含有8mol电子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com