
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解
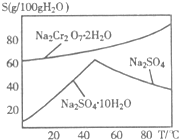 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
| ||
. |
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.酸性 B.氧化性 C.还原性 D.吸水性 E.脱水性 F.难挥发性
( )①Hg+2H2SO4(浓) ![]() HgSO4+SO2↑+2H2O
HgSO4+SO2↑+2H2O
( )②Cu(OH)2+H2SO4 ![]() CuSO4+2H2O
CuSO4+2H2O
( )③Fe2O3+3H2SO4 ![]() Fe2(SO4)3+3H2O
Fe2(SO4)3+3H2O
( )④2FeO+4H2SO4(浓) ![]() Fe2(SO4)3+4H2O+SO2↑
Fe2(SO4)3+4H2O+SO2↑
( )⑤2Al+3H2SO4(浓) ![]() Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
( )⑥MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
( )⑦2NaCl(s)+H2SO4(浓) ![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
( )⑧HCOOH浓H2SO4![]() CO↑+H2O
CO↑+H2O
( )⑨二氧化硫气体通过浓硫酸被干燥
( )⑩蘸取浓硫酸在白纸上写字,字迹变黑
( )⑾锌和稀硫酸的反应生成气体
( )⑿常温下,铁和铝在浓硫酸中“钝化”
( )⒀浓硫酸与磷酸钙混合能制得磷酸(磷酸属于弱酸)
( )⒁浓硫酸滴入浓盐酸中产生白雾
查看答案和解析>>
科目:高中化学 来源: 题型:
判定下列酸的作用,将正确答案代号填在题号前面的括号里。
A.酸性 B.氧化性
C.还原性 D.吸水性
E.脱水性 F.难挥发性
( )①Hg+2H2SO4(浓) ![]() HgSO4+SO2↑+2H2O
HgSO4+SO2↑+2H2O
( )②Cu(OH)2+H2SO4 ![]() CuSO4+2H2O
CuSO4+2H2O
( )③Fe2O3+3H2SO4 ![]() Fe2(SO4)3+3H2O
Fe2(SO4)3+3H2O
( )④2FeO+4H2SO4(浓) ![]() Fe2(SO4)3+4H2O+SO2↑
Fe2(SO4)3+4H2O+SO2↑
( )⑤2Al+3H2SO4(浓) ![]() Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
Al2O3+3SO2↑+3H2O(Al在浓H2SO4中的变化)
( )⑥MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
( )⑦2NaCl(s)+H2SO4(浓) ![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
( )⑧HCOOH浓H2SO4![]() CO↑+H2O
CO↑+H2O
( )⑨二氧化硫气体通过浓硫酸被干燥
( )⑩蘸取浓硫酸在白纸上写字,字迹变黑
( )??锌和稀硫酸的反应生成气体
( )??常温下,铁和铝在浓硫酸中“钝化”
( )??浓硫酸与磷酸钙混合能制得磷酸(磷酸属于弱酸)
( )??浓硫酸滴入浓盐酸中产生白雾
查看答案和解析>>
科目:高中化学 来源:河北省期中题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com