
【题目】已知酸性:![]() 综合考虑反应物的转化率和原料成本等因素,将
综合考虑反应物的转化率和原料成本等因素,将![]() 转变为
转变为![]() 的最佳方法是( )
的最佳方法是( )
A. 与稀H2SO4共热后,加入足量NaOH溶液
B. 与稀H2SO4共热后,加入足量NaHCO3溶液
C. 与足量的NaOH溶液共热后,再加入适量H2SO4
D. 与足量的NaOH溶液共热后,再通入足量CO2
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示一步转化)
a | b | c | d |
| |
① | S | SO2 | H2SO3 | H2SO4 | |
② | Si | SiO2 | H2SiO3 | Na2SiO3 | |
③ | Cu | CuO | CuSO4 | Cu(OH)2 | |
④ | N2 | NO | NO2 | HNO3 |
A. ②③ B. ①④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作,能达到实验目的的是( )
A.用向下排空气法收集NO
B.用瓷坩埚加热熔融NaOH固体
C.用湿润的蓝色石蕊试纸检验氨气
D.用饱和NaHCO3溶液除去CO2中混有的少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.
①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣905kJ/mol
②4NH3(g)+3O2(g)2N2(g)+6H2O(g)△H=﹣1268kJ/mol
下列说法中不正确的是( )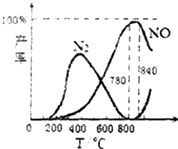
A.N2(g)+O2(g)2NO(g)△H=+181.5kJ/mol
B.NH3的燃烧热为226.25kJ/mol
C.工业上氨催化氧化生成NO时,温度应控制在780~840℃之间
D.用铂丝做催化剂,利用反应①来制备硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )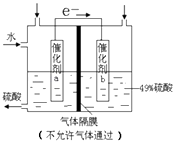
A.该装置将化学能转化为电能
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应是:SO2+2H2O﹣2e﹣=SO42﹣+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关双糖的说法一定正确的是( )
A.1 mol双糖水解生成2 mol葡萄糖B.麦芽糖和蔗糖的分子式均为C12H22O11
C.双糖为多羟基酮D.常见的双糖有蔗糖和果糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向紫色石蕊试液中加入过量Na2O2粉末振荡,下面对现象的叙述正确的是( )
A. 溶液最终为紫色 B. 溶液最终变为蓝色
C. 溶液中有气泡产生,最终为蓝色 D. 溶液中有气泡产生,最终为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律认为:不管化学过程是一步完成或分几步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A. Q1+ Q2+Q3 B. 0.5(Q1+Q2+Q3)
C. 0.5 Q2-1.5 Q1-0.5Q3 D. 1.5 Q1-0.5 Q2+0.5Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质(括号内为杂质)的提纯方法正确的是
A.丙烷(丙烯)——通入酸性高锰酸钾溶液
B.苯(苯酚)——加入氢氧化钠,分液
C.丙酸乙酯(丙酸)——加入稀硫酸
D.甘油(水)——分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com