
在298K时,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1 ,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
2SO3(g) ΔH=-197 kJ·mol-1 ,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
A.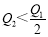 B.
B.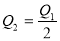 C.
C.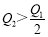 D.
D.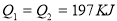
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
可检查淀粉部分发生水解的试剂是
A、碘水 B、碘化钾溶液
C、硝酸银溶液 D、银氨溶液、碘水
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省高一上学期期中化学试卷(解析版) 题型:选择题
有Na2SO4和Al2(SO4)3的混合溶液,已知其中 c(Al3+)= 0.4 mol/L,c(SO42-)= 0.7 mol/L,则此溶液中c(Na+)为
A.0.1mol/L B.0.2mol/L C.0.15mol/L D.0.25mol/L
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高二上学期期中化学(理)试卷(解析版) 题型:填空题
(16分)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)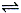 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物 质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
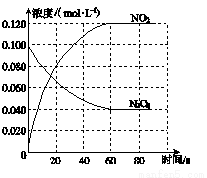
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高二上学期期中化学(理)试卷(解析版) 题型:选择题
已知反应FeO(s)+C(s)= CO(g)+ Fe(s)的△H>0,(假设△H,△S不随温度变化而变化),下列叙述中正确的是
A.低温下为自发过程,高温下为非自发过程
B.高温下为自发过程,低温下为非自发过程
C.任何温度下为非自发过程
D.任何温度下为自发过程
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列关于铜电极的叙述不正确的是
A.铜锌原电池中铜是正极
B.用电解法精炼铜时粗铜作阳极
C.在镀件上镀铜时可用铜作阳极
D.电解稀硫酸溶液制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高一第一学期期中化学试卷(解析版) 题型:填空题
(9分)取50.0mL K2CO3和K2SO4的混合溶液,加入过量BaCl2溶液后得到12.18g白色沉淀,用过量稀硝酸处理后沉淀量减少到2.33g,并有气体放出。试计算:
(1)原混合溶液中c(K2CO3) = ;c(K2SO4) = ;
(2)产生的气体在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源:2014秋安徽省宿州市高一第一学期期中化学试卷(解析版) 题型:选择题
下列氯化物中,不能用金属单质和氯气直接反应制得的是
A.CuCl2 B.FeCl2 C.MgCl2 D.NaCl
查看答案和解析>>
科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:选择题
在密闭容器中进行反应:A(g)+3B(g) 2C(g),有关下列图象说法的不正确的是
2C(g),有关下列图象说法的不正确的是

A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com