
N2(g)+3H2(g) ![]() 2NH3(g)?
2NH3(g)?
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。????
(2)反应达到平衡时,混合气体的体积为
(3)原混合气体与平衡混合气体的总物质的量之比n(始)∶n(平)=_______(写出最简整数比,下同)。?
(4)原混合气体中,a∶b=_______。?
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=_______。?
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=_______。?
解析:(1)解法一:由反应的化学方程式知,反应掉的N2和生成的NH3的物质的量之比为1∶2,设反应掉N2的物质的量为x。则x∶6 mol=1∶2,即x=3 mol。所以开始加入的N2的物质的量a=13 mol+3 mol=16 mol。?
解法二: N2+3H2![]() 2NH3?
2NH3?
开始时/mol a b 0?
反应掉/mol x 6?
t时刻/mol 13 6?
根据上述关系,解得x=3 mol。所以a=x+13 mol=16 mol。?
(2)平衡时NH3的物质的量为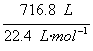 ×25%=32 mol×25%=8 mol。?
×25%=32 mol×25%=8 mol。?
(3)可利用差量法计算。假设反应过程中混合气体总物质的量减少y。?
N2+3H2![]() 2NH3 Δn?
2NH3 Δn?
1 3 2 2?
8 mol y?
解得y=8 mol,所以原混合气体总物质的量为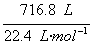 +8 mol=40 mol。原混合气体与平衡混合气体的总物质的量的之比为40∶32=5∶4。?
+8 mol=40 mol。原混合气体与平衡混合气体的总物质的量的之比为40∶32=5∶4。?
(4)前面已计算出原混合气体中a=16,所以H2的物质的量b=40 mol-16 mol=24 mol。所以a∶b=16∶24=2∶3。?
(5)反应过程中各物质的物质的量如下:?
N2 +3H2![]() 2NH3?
2NH3?
开始时/mol: 16 24 0?
转化/mol: 4 12 8?
平衡时/mol: 12 12 8?
可以算出N2、H2的转化率之比为:α(N2)∶α(H2)=![]() =1∶2。?
=1∶2。?
(6)根据(5)中的数据,平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=12∶12∶8=3∶3∶2。
答案:(1)16 (2)8 mol (3)5∶4 (4)2∶3 (5)1∶2 (6)3∶3∶2


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 | 高温高压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com