
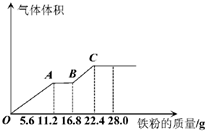
 常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
 常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )| A、原混合酸中NO3-的物质的量为0.2mol | B、原混合酸中H2SO4物质的量浓度为2mol/L | C、取25mL原混合酸加水稀释至1L后溶液的pH=1 | D、OA段与BC段反应中电子转移的物质的量之比为3:1 |
查看答案和解析>>
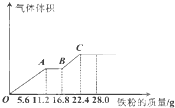
科目:高中化学 来源:2013-2014学年江西省协作体高三第一次联考理综化学试卷(解析版) 题型:选择题
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列有关分析错误的是
A.原混合酸中NO3—的物质的量为0.2 mol
B.原混合酸中H2SO4物质的量浓度为2 mol/L
C.取25mL原混合酸加水稀释至1 L后溶液的pH =1
D.OA段与BC段反应中电子转移的物质的量之比为3:1
查看答案和解析>>
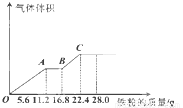
科目:高中化学 来源:2011-2012学年甘肃省天水市高三第四阶段考试化学试卷 题型:选择题
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列有关分析错误的是
A.原混合酸中NO3—的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH =1
查看答案和解析>>
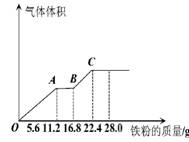
科目:高中化学 来源:2011--2012学年湖北省高三第一次联考试题化学试卷 题型:选择题
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列有关分析错误的是( )
A.原混合酸中NO3—的物质的量为0.2mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH =1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com