
将一定质量的MgAl合金投入100 mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5 mol·L-1 NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如图4-7所示。
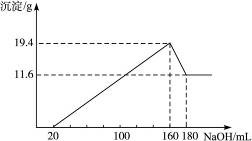
图4-7
求:(1)原合金中Mg、Al质量各多少克。
(2)HCl物质的量浓度。
(1)Mg:4.8 gAl:2.7 g
(2)c(HCl)=8 mol·L-1
由图可知,11.6 g是Mg(OH)2沉淀的质量,(19.4-11.6)g是Al(OH)3的质量,当V(NaOH)=20 mL时,中和HCl,无沉淀生成。
(1)Mg~Mg(OH)2
24 58
m(Mg) 11.6 g
m(Mg)=![]() =4.8 g
=4.8 g
Al ~ Al(OH)3
27 78
m(Al) 7.8 g
m (Al)=![]() =2.7 g
=2.7 g
(2)当V(NaOH)=160 mL时,此时Mg2+、Al3+分别全部以Mg(OH)2、Al(OH)3沉淀的形式存在,则溶液中n(Cl-)=n(Na+)=0.16 L×5 mol·L-1=0.8 mol
所以c(HCl)=![]() =8 mol·L-1。
=8 mol·L-1。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com