
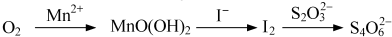
分析 (1)O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可知反应的离子方程式为:O2+2Mn2++4OH-=MnO(OH)2;
(2)MnO(OH)2与I-完全反应生成Mn2+和I2,锰元素由+4价变成+2价,而碘元素由-1变成0价,所以两者最小公倍数为2,由此书写化学方程式.
解答 解:(1)O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可知化学方程式为:O2+2MnSO4+4KOH=2MnO(OH)2↓+2K2SO4
,故答案为:O2+2MnSO4+4KOH=2MnO(OH)2↓+2K2SO4;
(2)MnO(OH)2与I-完全反应生成Mn2+和I2,锰元素由+4价变成+2价,而碘元素由-1变成0价,所以两者最小公倍数为2,所以化学方程式为:MnO(OH)2+2H2SO4+2KI=MnSO4+I2+3H2O+K2SO4,故答案为:MnO(OH)2+2H2SO4+2KI=MnSO4+I2+3H2O+K2SO4.
点评 本题主要考查了氧化还反应方程式的书写,题目难度中等,注意掌握常见的钠及其化合物的性质,能够正确书写化学方程式.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氯化铝溶液 | C. | 稀氨水 | D. | 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阴极质量增加6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 10g 46%乙醇溶液中含氧原子0.1NA | |
| D. | 苯与液溴反应生成1mol 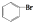 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的浊液中 | Ksp(AgCl)>Ksp(Ag2S) |
| B | 室温下,向浓度均为0.1 mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| D | 室温下,用pH试纸测得0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com