
mA(气) + nB(气) pC(气) + qD(气)的 C %与时间 t有如图关系
pC(气) + qD(气)的 C %与时间 t有如图关系
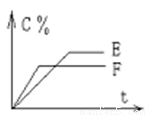
(1)若E、F表示两种温度,则 E____F(填“>”、“<”或“=”),正反应____ 热。
(2)若E、F表示两种压强,则 m + n_____p + q。
科目:高中化学 来源:2015届江西省高三上学期第一次考试化学试卷(解析版) 题型:选择题
已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6∶1
D.反应③中0.1mol还原剂共失去电子数为1.2×1022
查看答案和解析>>
科目:高中化学 来源:2015届江西五校高三第一次联考化学试卷(解析版) 题型:选择题
在同温同压下,一定量的某有机物和过量的金属钠反应产生aL氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体bL,若a=b,则该有机物可能是( )
A.HOOC-COOH B.HOOC-CHCH2OH
C.HOCH2-CH2OH D.CH3COOH
查看答案和解析>>
科目:高中化学 来源:2015届江苏省苏州市高三9月学情调研化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O → C6H5OH+HCO3-
B.AlCl3溶液中加入少量氨水:Al3++3OH- = Al(OH)3↓
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH- = Fe(OH)2↓
D.用惰性电极电解氯化钠溶液:2Cl-+2H+ 通电 H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:填空题
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
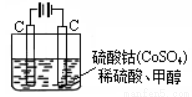
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极负极反应式,负极: 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
A.2CH4(g) + 4O2(g) = 2CO2(g) + 4H2O(l) ΔH=+890kJ·mol-1
B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH=+890kJ·mol-1
C.CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH=-890kJ·mol-1
D.1/2CH4(g) + O2(g) = 1/2CO2(g) + H2O(l) ΔH=-890kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
根据碘与氢气反应的热化学方程式
(1) I2(g)+ H2(g) 2HI(g) △H = -9.48 kJ/mol
2HI(g) △H = -9.48 kJ/mol
(2) I2(S)+ H2(g) 2HI(g) △H = +26.48 kJ/mol
2HI(g) △H = +26.48 kJ/mol
下列判断正确的是
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(1)的产物比反应(2)的产物稳定
D.反应(2)的反应物总能量比反应(1)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:填空题
(10分)可逆反应aA(g) + bB(g) cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。

试比较下列大小关系:T1 T2, P1 P2, ΔH 0,ΔS 0。 使用催化剂的是 反应线。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:填空题
碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32- 2I-+ S4O62-(快)
2I-+ S4O62-(快)
向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
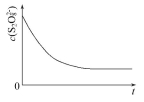
碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为: 2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知: ①4Li(s)+O2(g) 2Li2O(s) ΔH1 ②4LiI(s)+O2(g)
2Li2O(s) ΔH1 ②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com