
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①④⑥⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
【答案】C
【解析】
试题分析:①氢离子提供空轨道,N2H4氮原子提供孤电子对,所以能形成配位键,N2H5+含有配位键;②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键;③OH-电子式为![]() ,无空轨道,OH-不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;⑤Fe3+有空轨道,CO中的氧原子上的孤电子对,可以形成配位键,Fe(CO)3含有配位键;⑥SCN-的电子式
,无空轨道,OH-不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;⑤Fe3+有空轨道,CO中的氧原子上的孤电子对,可以形成配位键,Fe(CO)3含有配位键;⑥SCN-的电子式![]() ,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键;⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2OH含有配位键;故选C。
,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键;⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2OH含有配位键;故选C。


科目:高中化学 来源: 题型:
【题目】已知X是一种具有果香味的合成香料,下图为合成X的某种流程:

提示:①![]() 不能最终被氧化为-COOH;
不能最终被氧化为-COOH;
②D的产量可以用来衡量一个国家的石油化工水平。
请根据以上信息,回答下列问题:
(1)D与C分子中官能团的名称分别是____________,E的结构简式是____________。
(2)D→E的化学反应类型为____________反应。
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是____________。
(4)反应C+E→X的化学方程式为___________________________________________。
(5)反应B→C的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L氯化氢气体溶于635 mL的水(密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。求:
(1)该盐酸的溶质质量分数是多少?
(2)取这种盐酸10.0 mL,稀释到1.00 L,所得的稀盐酸的物质的量浓度多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据

下列有关叙述正确的是
A. 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧
B. 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4
C. 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族
D. 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·北京市第四中学高一上学期期末考试)Ⅰ.下面是几种实验中常用的仪器:

写出序号所代表的仪器的名称:
A__________;B__________;C__________;D__________;E__________。
Ⅱ.实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和__________________。
(2)用托盘天平称取氯化钠固体,其质量为__________g。
(3)下列主要操作步骤的正确顺序是____________________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度__________ (填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增, a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是
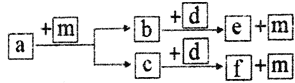
A. 简单离子半径:Z>Y
B. Z2Y2中既含有离子键又含有共价键,其中阳离子和阴离子的比值为2∶1
C. 简单气态氢化物的热稳定性:Y>X
D. 由上述4种元素组成的化合物属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:

(1)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4,生成1mol PbSO4,转移电子的物质的量是________mol。Fe2+催化过程可表示为:
①2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
②______________________。(用离子方程式表示反应②)
(2)写出脱硫过程发生主要反应的化学方程式:_______________________________。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)==NaHPbO2(aq),其溶解度曲线如右图所示。

②粗品PbO中所含杂质不溶于NaOH溶液。结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量______(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HC1和NaC1的混合溶液中,得到含Na2PbC14的电解液,电解Na2PbC14溶液,生成Pb,如右图所示。

①阴极的电极反应式是__________________________。
②电解一段时间后,Na2PbC14浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如右。据图回答:

(1)作正极的是__________。
(2)负极的电极反应是_____________________________
(3)许多国家对废电池进行回收,其主要原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上“固定”和利用CO2能有效地减轻“温室效应”。
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):

回答下列问题:
(1)该反应在______条件下能自发进行(城编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常教为K,虚线I对应条件下平衡常数为K1,盛线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是______。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:

(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0 . lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的
pH=6,那么混合液中 =_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com