
【题目】(1)基态溴原子的核外电子排布式为________,其核外电子所占用的最高能级电子云形状为_________。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____,σ键与π键数目之比为______。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4)NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
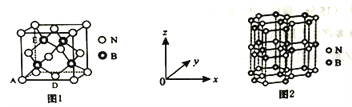
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为________。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___pm.
【答案】 [Ar]3d104s24p5 哑铃形或纺锤形 sp2、sp3 7:1 BD NH3分子中N原子的孤对电子进入Zn2+的空轨道形成配离子后,原孤对电子对NH键的成键电子对的排斥作用变为成键电子对之间的排斥,排斥作用减弱 (0.25,0.75,0.75) ![]()
【解析】(1)溴的原子的质子数为35,核外电子数为35,由核外电子排布规律可知其电子排布式为1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5;其核外电子所占用的最高能级为4p能级,电子云形状为哑铃形或纺锤形;(2)由尿素分子的结构式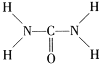 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;分子中含有7个σ键和1个π键,σ键与π键数目之比为7:1;(3)铍与相邻主族的铝元素性质相似。A.Be属于s区,Al属于p区,选项A错误;B.电负性都比镁大,选项B正确;C.第二周期元素Mg的第一电离能比第三周期Al的大,选项C错误;D.氯化物的水溶液均发生水解,溶液显酸性,则pH<7,选项D正确。答案选BD;(4) NH3分子中N原子的孤对电子进入Zn2+的空轨道形成配离子后,原孤对电子对NH键的成键电子对的排斥作用变为成键电子对之间的排斥,排斥作用减弱,故配离子[Zn(NH3)6]2+中∠HNH键角变大;(5) ①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。根据图中信息可知,图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为(0.25,0.75,0.75);②根据均摊法可知,晶胞中含有
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;分子中含有7个σ键和1个π键,σ键与π键数目之比为7:1;(3)铍与相邻主族的铝元素性质相似。A.Be属于s区,Al属于p区,选项A错误;B.电负性都比镁大,选项B正确;C.第二周期元素Mg的第一电离能比第三周期Al的大,选项C错误;D.氯化物的水溶液均发生水解,溶液显酸性,则pH<7,选项D正确。答案选BD;(4) NH3分子中N原子的孤对电子进入Zn2+的空轨道形成配离子后,原孤对电子对NH键的成键电子对的排斥作用变为成键电子对之间的排斥,排斥作用减弱,故配离子[Zn(NH3)6]2+中∠HNH键角变大;(5) ①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。根据图中信息可知,图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为(0.25,0.75,0.75);②根据均摊法可知,晶胞中含有![]() 个N原子,4个B原子,已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,V=
个N原子,4个B原子,已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,V=![]() ,则层与层之间距离的表达式为
,则层与层之间距离的表达式为![]() pm。
pm。


科目:高中化学 来源: 题型:
【题目】锌溴液流电池用溴化锌溶液作电解液,并在电池间不断循环。下列有关说法正确的是
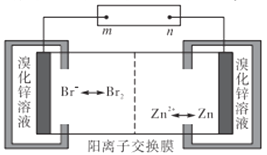
A. 充电时n接电源的负极,Zn2+通过阳离子交换膜由左侧流向右侧
B. 放电时每转移1mol电子负极区溶液质量减少65g
C. 充电时阴极的电极反应式为Br2+2e-=2Br-
D. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品中Na2CO3的纯度(质量分数)是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:
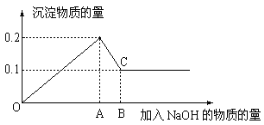
(1)图中C点表示当加入________mol NaOH时,Al3+已完全转化为____________(填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为 ____________。
(3)写出AB段发生反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.己知某些化学键的键能数据如下:
化学键 | C=O | C-O | C-H | H-H | O-H |
键能/kJ·mol-1 | a | b | c | d | e |
(1)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
II.将燃煤废气中的CO 转化为二甲醚的反应原理为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H_____0(填“>”或“<”)。
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~3min内的生成速率为_________。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是_______。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0molCO26.0molH2 | 0.10mol | 0.04mol | 0.02mol |
II.1.0molCH3OCH33.0molH2O | X1 | Y1 | Z1 |
①P3______P2(填“>”、“<”或“”);
②P2下,I中CH3OCH3的平衡转化率为_______。
III.在一定条件下,CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(5)在1L密闭容器中若CO2(g)、H2(g)初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=____。向此容器中再充入CO2(g)、H2(g)各0.5mol,则平衡_______(填“正向移动”、“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
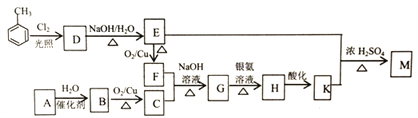
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
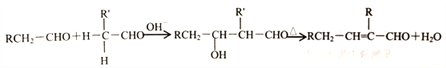
请回答下列问题:
(1)K的名称是_______;G中含有的官能团名称是_______ 。
(2)写出D→E的化学方程式_______ 。
(3)A-B的反应类型是_______;M的结构简式是_______ 。
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。
①遇FeCl溶液发生显色反应;
②能发生银镜反应;
③除苯环以外不再含有其他环状结构。
其中核磁共振氢谱为五组峰的结构简式为_______。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,完善以下合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)______。
CH3CH2OH![]() CH3CHO
CH3CHO![]() ……
……![]() ……
……![]() CH3CH2CH=CH2
CH3CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于四种基本反应类型,但不属于氧化还原反应的是( )
A. Fe+CuSO4═FeSO4+Cu B. CO+CuO![]() Cu+CO2
Cu+CO2
C. AgNO3+NaCl═AgCl↓+NaNO3 D. 2FeCl2+Cl2═2FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸法是在一定温度下盐酸与铝土矿、高岭土或粉煤灰等固体中的活性Al2O3发生反应制备Al2O3的工艺。氯化铝溶液可通过蒸发结晶生成结晶氯化铝,进而焙烧得到氧化铝;也可利用氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低的特点,生成氯化铝晶体,从而焙烧得到氧化铝。图1是我国某公司研发的具有自主知识产权的“一步酸溶法”工艺流程。
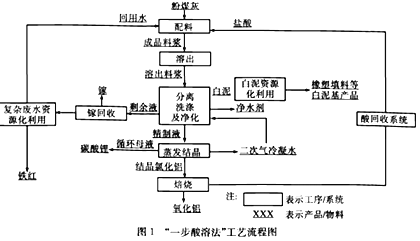
回答下列问题:
(1)“氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低”的原因是________________________________________________________(结合必要的化学方程式说明)。
(2)精制液蒸发结晶后分离出纯净结晶氯化铝的操作名称是_______,用_____洗涤。
(3)写出结晶氯化铝(AlCl3·6H2O)焙烧的化学方程式:_____________________________。
(4)工业上冶炼金属铝的方法是电解熔融的_______(填化学式),电解过程中作阳极的石墨易消耗,原因是___________________________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com