
(16分)废旧锂离子电池的正极材料(主要含有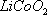 及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
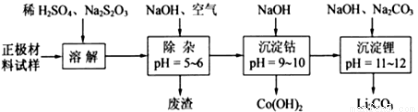
已知:Fe3+开始沉淀pH=2.7, 完全沉淀pH=3.2; Al3+开始沉淀pH=3.8, 完全沉淀pH=5.2; Co2+完全沉淀pH=9.15
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为 ,氧化剂是_________________________________。
(2)在上述除杂过程中,通入空气的作用是_____________________。通入空气和加入NaOH溶液后发生的离子方程式是______________ 废渣的主要成分是Al (OH)3和_______________。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为_________________、_________________。
(4)该工艺可回收的副产品是_________________________(写化学式)。
(1)8 LiCoO2+ Na2S2O3+11H2SO4=4Li2SO4+ 8CoSO4+Na2SO4+11H2O;(3分)LiCoO2 (2分)
(2)将正二价铁元素氧化成正三价 (2分)
4Fe2 + + O2 + 2H2O + 8OH-= 4Fe(OH)3↓(3分);Fe(OH)3(2分)
(3)Co2++2OH-=Co(OH)2↓(1分) 2Li++CO32-=Li2CO3↓(1分);(4)Na2SO4(2分)。
【解析】
试题分析:(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中被还原为CoSO4,根据元素的化合价升降总数相等及元素的原子个数相等,可得该反应的化学方程式是8LiCoO2+ Na2S2O3+11H2SO4=4Li2SO4+ 8CoSO4+Na2SO4+11H2O;在该反应中氧化剂是LiCoO2;(2)由于Fe2+形成沉淀的溶液的pH与Co2+完全沉淀的pH很接近,不容易分离,若将在上述除杂过程中,将Fe2+氧化为Fe3+,就因为溶液的pH差别很大,容易分离,所以通入空气的作用是将正二价铁元素氧化成正三价的铁元素;通入空气和加入NaOH溶液后发生的离子方程式是4Fe2 + + O2 + 2H2O + 8OH-= 4Fe(OH)3↓;产生的废渣的主要成分是Al (OH)3和Fe(OH)3;(3)根据框图示意可得“沉淀钴”和“沉淀锂”的离子方程式分别为Co2++2OH-=Co(OH)2↓(1分) 2Li++CO32-=Li2CO3↓;(4)结合流程图及元素守恒可知:该工艺可回收的副产品是Na2SO4。
考点:考查物质制取的工艺过程,主要包括反应条件的控制、化学方程式和离子方程式的书写、守恒法的应用及物质的循环利用的知识。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
| A、明矾既可以除去水中的悬浮物,也可以杀菌消毒 | B、可以通过电解明矾溶液来制取Al | C、用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高 | D、可以用在某溶液中加入盐酸酸化的氯化钡溶液的方法来确定该溶液中是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
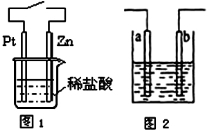
A.与铜质水龙头连接处的钢质水管不易发生腐蚀
B.用电解法提取氯化铜废液中的铜,可以用碳棒连接电源的正极,另一电极用铜片
C.图1中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图2所示装置可发生反应的离子方程式为Zn + 2H+=Zn2++ H2↑,且a、b电极不可能是同种材料
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:实验题
(16分) 硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
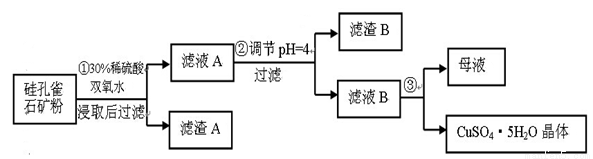
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A. CuO B.Fe2O3 C.Al2O3 D.Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(4)将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 氢氟酸具有酸性 | 氢氟酸可用于雕刻玻璃 |
B | SO2有氧化性 | SO2可用于漂白纸浆 |
C | NH3极易溶于水 | NH3可用作制冷剂 |
D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)Ⅰ.已知下列反应的热化学方程式为:
C(s) + O2(g) CO2(g) ΔH1 = -393.5 kJ/mol
CO2(g) ΔH1 = -393.5 kJ/mol
CH3COOH(l) + 2O2(g) 2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2H2(g) + O2(g) 2H2O(l) ΔH 3 = -571.6 kJ/mol
2H2O(l) ΔH 3 = -571.6 kJ/mol
请计算2C(s) + 2H2(g) + O2(g) CH3COOH(l) ΔH 4 = 。
CH3COOH(l) ΔH 4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2  2(t-BuNO)
2(t-BuNO)
该温度下该反应在CCl4溶剂中的平衡常数为1.4 mol/L。
(1)向1 L正庚烷中加入0.50 mol (t-BuNO)2,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1 L)。反应在前10 min内的平均速率为v(t-BuNO)= 。计算上述反应的平衡常数K。(写出计算过程,计算结果保留3位有效数字)
(2)有关反应:(t-BuNO)2  2(t-BuNO) 的叙述正确的是________
2(t-BuNO) 的叙述正确的是________
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.09 | 0.094 | 0.096 | 0.096 |

Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通入甲醇的电极反应式为 。若通空气的电极上有32g O2参加反应,则反应过程中转移了______ mol e-。
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是
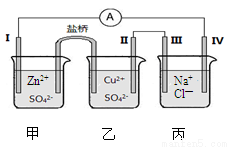
A.电子由电极IV通过外电路流向电极I
B.装置工作过程中III电极周围出现红色
C.电极II发生还原反应
D.盐桥中Cl—向乙池移动
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol S在足量O2中燃烧,转移的电子数为6 NA
B.标况下,22.4L氦气含有的原子数为2NA
C.28 g C2H4中含有2 NA个碳原子
D.0.1 mol·L-1的碳酸氢钠溶液中含钠离子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com