
Ⅰ已知在常温常压下:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)?? △H=_1275.6kJ?mol-1
②H2O(l)═H2O(g)?? △H=+44.0kJ?mol-1写出表示甲醇燃烧热的热化学方程式:??????????????? 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 ???? 。
(2)判断 ⑴ 中可逆反应达到平衡状态的依据是(填序号) ??????????? 。
①v正(CH3OH) = 3v逆(H2) ? ②混合气体的密度不变 ③混合气体的平均相对分子质量不变?????? ④CH3OH、H2O、CO2、H2的浓度都不再发生变化???? ⑤CO2和H2的浓度之比为1:3
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。? 已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。

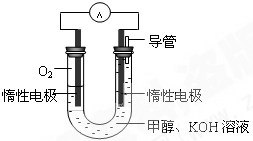
Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题:

(1)若两池中均盛放CuSO4溶液
①甲池中石墨棒上的电极反应式为____________________.
②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则其电解后的pH为????? (忽略溶液体积的变化)。
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
ⅠCH3OH(l)+3/2O2(g)═CO2(g)+2H2O(l) ;△H=_725.8kJ?mol-1?
Ⅱ.(1)0.01mol/(L·s)? (2)? ③④???? (3)75%????? 1.75a
Ⅲ.(1)①Cu2++2e- = Cu(1分)??? ② 1?
(2)O2 + 2H2O + 4e- = 4OH-(2分)???
【解析】
试题分析:Ⅰ.根据燃烧热的概念结合题给反应:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H=_1275.6kJ?mol-1②H2O(l)═H2O(g)?? △H=+44.0kJ?mol-1利用盖斯定律:①×1/2—②×2得表示甲醇燃烧热的热化学方程式:CH3OH(l)+3/2O2(g)═CO2(g)+2H2O(l) ;△H=_725.8kJ?mol-1;Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0(1)根据阿伏加德罗定律:等温等容条件下,气体的压强之比等于气体的物质的量之比,分析题意知,反应前气体的总物质的量为4mol,20s后,测得混合气体的压强是反应前的1.2倍,则混合气体的物质的量为4.8mol,增加0.8mol,结合反应方程式CH3OH(g) + H2O(g)
CO2(g) + 3H2(g) ;△H>0(1)根据阿伏加德罗定律:等温等容条件下,气体的压强之比等于气体的物质的量之比,分析题意知,反应前气体的总物质的量为4mol,20s后,测得混合气体的压强是反应前的1.2倍,则混合气体的物质的量为4.8mol,增加0.8mol,结合反应方程式CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) 利用差量法计算,参加反应甲醇的物质的量为0.4mol,根据v=△n/V△t计算,用甲醇表示该反应的速率为0.01mol/(L·s);(2)①v正(CH3OH) = 3v逆(H2),不符合v正 = v逆,错误;②根据密度的定义式判断,混合气体的密度不随反应的进行而变化,为恒量,不能作为平衡标志,错误;③根据摩尔质量的定义判断,混合气体的平均相对分子质量随反应的进行不断变化,当其不变时已达平衡,正确;④CH3OH、H2O、CO2、H2的浓度都不再发生变化,正确;⑤平衡时CO2和H2的浓度之比不一定为1:3,错误,选③④ ;(3)根据题给装置图判断,B容器维持温度和压强不变,根据阿伏加德罗定律:等温等压下气体的体积之比等于气体的物质的量之比, 已知起始时容器B的体积为aL,反应达到平衡时容器B的体积为1.5aL,反应前容器B中气体的总物质的量为3.6mol,则平衡后混合气体的物质的量为5.4mol,气体物质的量增加1.8mol,结合题给方程式利用差量法计算参加反应CH3OH的物质的量为0.9mol,转化率为75%;维持其他条件不变,若打开K一段时间后,相当于2.2molCH3OH(g) 和4.4molH2O(g)反应在等温等压条件下进行,重新达到平衡,根据等效平衡知识判断,气体的总体积为2.75aL,则容器B的体积为1.75aL;Ⅲ.(1)①甲池为原电池,石墨棒作正极,电极反应式为Cu2++2e- = Cu;②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则电解生成0.01mol铜和0.005mol氧气,根据电极反应式
CO2(g) + 3H2(g) 利用差量法计算,参加反应甲醇的物质的量为0.4mol,根据v=△n/V△t计算,用甲醇表示该反应的速率为0.01mol/(L·s);(2)①v正(CH3OH) = 3v逆(H2),不符合v正 = v逆,错误;②根据密度的定义式判断,混合气体的密度不随反应的进行而变化,为恒量,不能作为平衡标志,错误;③根据摩尔质量的定义判断,混合气体的平均相对分子质量随反应的进行不断变化,当其不变时已达平衡,正确;④CH3OH、H2O、CO2、H2的浓度都不再发生变化,正确;⑤平衡时CO2和H2的浓度之比不一定为1:3,错误,选③④ ;(3)根据题给装置图判断,B容器维持温度和压强不变,根据阿伏加德罗定律:等温等压下气体的体积之比等于气体的物质的量之比, 已知起始时容器B的体积为aL,反应达到平衡时容器B的体积为1.5aL,反应前容器B中气体的总物质的量为3.6mol,则平衡后混合气体的物质的量为5.4mol,气体物质的量增加1.8mol,结合题给方程式利用差量法计算参加反应CH3OH的物质的量为0.9mol,转化率为75%;维持其他条件不变,若打开K一段时间后,相当于2.2molCH3OH(g) 和4.4molH2O(g)反应在等温等压条件下进行,重新达到平衡,根据等效平衡知识判断,气体的总体积为2.75aL,则容器B的体积为1.75aL;Ⅲ.(1)①甲池为原电池,石墨棒作正极,电极反应式为Cu2++2e- = Cu;②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则电解生成0.01mol铜和0.005mol氧气,根据电极反应式
2H2O - 4e-=O2↑ + 4H+ 判断,生成的氢离子物质的量为0.02mol,物质的量浓度为0.1mol/L,则其电解后的pH为1;(2)若甲池中盛放饱和NaCl溶液,则甲池为钢铁的吸氧腐蚀,石墨棒上的电极反应式为O2 + 2H2O + 4e- = 4OH-。
考点:考查热化学方程式的书写、盖斯定律及燃烧热的概念,化学平衡计算及差量法、等效平衡,原电池原理及电解原理的应用。


科目:高中化学 来源: 题型:阅读理解
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 温度°C | 起始量/mol | 平均量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com