
CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法不正确的是

A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
C.CuSO4在1100℃分解所得混合气体X一定有O2
D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:1
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:2015-2016学年河南省高二开学考试化学试卷(解析版) 题型:选择题
在恒温、恒容容器中,反应A(s)+2B(g) C(g)+D(g)已达平衡状态的标志是
C(g)+D(g)已达平衡状态的标志是
A.混合气体的压强不随时间变化而变化
B.混合气体的密度不随时间变化而变化
C.气体总物质的量不随时间变化而变化
D.单位时间内生成n mol C,同时消耗2n mol B
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一入学摸底化学试卷(解析版) 题型:填空题
下图中各步反应的最后产物D是一种饱和一元醇,其蒸气的密度是相同状况下H2密度的23倍。试回答:

(1)结构简式:A________,D________;
(2)反应类型:⑥________,⑧________;
(3)写出化学反应方程式:④________,⑥________,⑦________,⑧________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二9月检测化学试卷(解析版) 题型:推断题
A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种,并有如图所示关系:
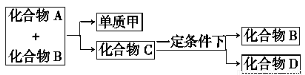
回答下列问题:
(1)A、B、C、D的化学式分别为:
A________,B________,C________,D________。
(2)在常温下A、B通过________途径转化为C,而人体内的蛋白质是由各种________通过缩聚而成。
(3)工业上制备D有两种方法,一是乙烯合成法,二是农作物秸秆发酵法,请写出有关的化学反应方程式及反应类型_________________。
(4)油脂水解生成的醇与D是否为同系物________(填“是”或“否”),请写出硬脂酸甘油在碱性条件下发生皂化反应的化学方程式___________。
(5)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响,发生这种变化的原因是_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二9月检测化学试卷(解析版) 题型:选择题
下列食品中加入的成分不是营养强化剂的是
A.食盐中加碘 B.酱油中加铁
C.食品中加硒 D.火腿中加亚硝酸钠
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三第一次月考试卷化学试卷(解析版) 题型:选择题
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1molHCl气体中的粒子数与1L0.5 mo1/L盐酸中溶质粒子数相等
C.6.4g铜与足量的硫磺在绝隔空气的条件下反应,电子转移的数目为0.1NA
D.1mol白磷分子中所含共价键数为4NA 
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三9月月考化学试卷(解析版) 题型:选择题
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A.若无固体等剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期入学考试化学试卷(解析版) 题型:选择题
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水合氯化钙可用作食品干 燥剂
燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(15分)硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐。其化学式为:FeSO4•(NH4)2SO4•6H2O硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。三种盐的溶解度(单位为g/100g水)如下表:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
如图是模拟工业制备硫酸亚铁铵晶体的实验装置
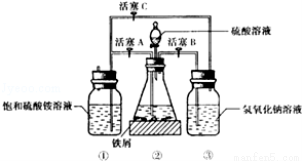
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是 。将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为 (填序号)
A.Fe + 2H+=Fe2+ +H2↑ B.Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++H2S=2Fe2++S↓+2H+ D.2Fe3++Fe=3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。容器③中NaOH溶液的作用是 ;向容器①中通人氢气的目的是 。
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是 ;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是 。
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液。用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO?4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在 (填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 ;晶体中FeSO4的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com