
| ① | He:-268.8 | Ne:-246 | Ar:-185.7 | Kr:-153.3 |
| ② | F2:-188.1 | Cl2:-34.6 | Br2:+58.8 | I2:+184 |
| ③ | NH3:-33 | PH3:-83 | AsH3:-55 | SbH3:-18.8 |
| ④ | H2O:+100 | H2S:-61 | H2Se:-41 | H2Te:-2 |
| ⑤ | HF:+20 | HCl:-85 | HBr:-67 | HI:-36 |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:



| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(带解析) 题型:填空题
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: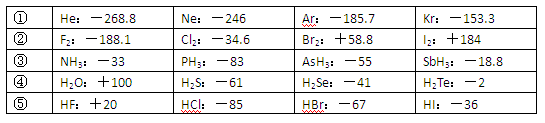
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高一上学期期末考试化学试卷(解析版) 题型:填空题
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示:
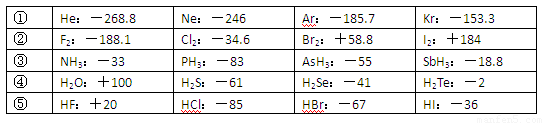
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
A.同周期元素的氢化物,原子序数越大,沸点越高
B.上表中H2O、HF中由于含有氢键,故其分子特别稳定
C.上表中,多数物质的沸点均与相对分子质量存在一定的关系
D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
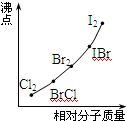
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围 (填“物质的化学式”)。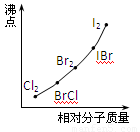
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com