

| A. | 甲:醋酸;乙:纯碱;丙:苯酚钠溶液 证明酸性:CH3COOH>H2CO3>C6H5OH | |
| B. | 甲:10%过氧化氢溶液;乙:二氧化锰;丙:硫酸酸化的KI溶液 证明氧化性:O2>I2 | |
| C. | 甲:浓盐酸;乙:KMnO4 丙:KBr溶液 证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲:饱和食盐水;乙:电石;丙:溴水 证明稳定性:H2O>C2H2>Br2 |
分析 A.醋酸易挥发,醋酸能与苯酚钠反应;
B.过氧化氢分解生成氧气,氧气可氧化KI;
C.浓盐酸与高锰酸钾发生氧化还原反应生成氯气,氯气与KBr反应生成溴;
D.电石与水反应生成乙炔,乙炔可与溴水发生加成反应.
解答 解:A.醋酸易挥发,醋酸能与苯酚钠反应,该装置不能比较碳酸、苯酚的酸性,故A错误;
B.过氧化氢分解生成氧气,氧气可氧化KI,丙中颜色加深,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:O2>I2,故B正确;
C.浓盐酸与高锰酸钾发生氧化还原反应生成氯气,氯气与KBr反应生成溴,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:KMnO4>Cl2>Br2,故C正确;
D.电石与水反应生成乙炔,乙炔可与溴水发生加成反应,但该装置和发生的反应不能证明H2O、C2H2、Br2稳定性,故D错误;
故选BC.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、发生的反应及实验结论为解答的关键,侧重分析与实验能力的考查,注意酸性比较、氧化还原反应应用及实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)+c(C2O42-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
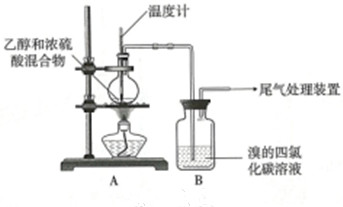
| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2MnO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
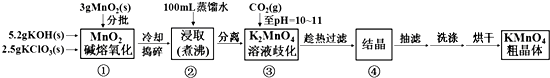
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol•L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol | |
| B. | 0.1 mol水蒸气在标准状况下体积为2.24 L | |
| C. | 在25℃,1.01×105Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 | |
| D. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com