(1)体积相同,pH相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率______,充分反应后,产生氢气的量______(相同、盐酸的多、醋酸的多).
(2)在一定量的盐酸溶液中加入足量的锌粒,若使产生氢气的量保持不变,但反应速率加快,可加入______晶体,要使产生氢气的量不变,但反应速率减慢,可加入______晶体.
可选择的晶体有:
(A) 纯碱 (B)烧碱 (C)胆矾 (D) 醋酸钠 (E) KHSO
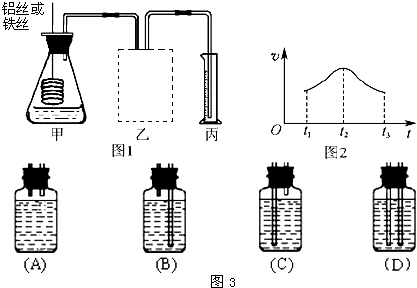
4(3)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图1所示的装置.
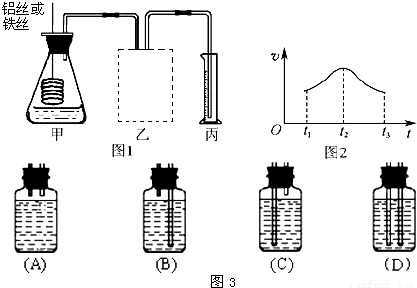
①在如图3所示的虚线框内连接合适的装置______.
②若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量______.
③实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t
1~t
2时间段内反应速率逐渐加快的主要原因是______.




 名校课堂系列答案
名校课堂系列答案