
【题目】溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是( )
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO和SiO一定存在于溶液X中 D. CO和SO一定不存在于溶液X中
【答案】C
【解析】试题分析:加入过量的稀盐酸有气体产生,说明CO32-、SO32-至少有一种,气体甲中CO2、SO2至少有一种。镁离子、铝离子与CO32-、SO32-均不能大量共存,一定不存在镁离子、铝离子;加入过量的盐酸有沉淀,说明一定有硅酸根离子,沉淀甲是硅酸。无色溶液中加入过量氨水有沉淀生成,该沉淀只能是氢氧化铝沉淀,说明此时溶液中存在铝离子。由于原溶液中的铝离子一定不存在,所以该铝离子是偏铝酸根离子和盐酸反应生成的,则一定存在偏铝酸根离子。根据溶液的电中性可知一定含有K+离子。A、根据以上分析可知气体甲不一定是纯净物,A错误;B、根据以上分析可知沉淀甲是硅酸,不可能是硅酸镁,B错误;C、根据以上分析可知原来溶液中K+、AlO2-和SiO32-一定存在,C正确;D、根据以上分析可知硫酸根离子不能确定是否存在,CO32-可能存在,D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C. 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH![]() )=c(Cl-)
)=c(Cl-)
D. 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是( )
A. 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-=BaSO4↓+Al(OH)3↓
B. 将铁粉加入到稀硫酸种:2Fe+6H+=2Fe3++3H2↑
C. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O
D. NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的外成层电子数相同。
(1)Z离子的结构示意图是_____________________________。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是_______,其中含有的化学键有__________________。
(3)X与Y所形成的分子的电子式为__________,它比同主族其他元素的氢化物沸点高的原因是__________________。
(4)请从Z、W的结构上说明Z、W两种元素非金属性的强弱_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下N2H4为液体,可作为火箭发动机的燃料,与氧化剂N2O4发生反应:2N2H4 + N2O4 ![]() 3N2 + 4H2O。分子球棍模型如下图所示,NA为阿伏加德罗常数的值,下列叙述正确的是
3N2 + 4H2O。分子球棍模型如下图所示,NA为阿伏加德罗常数的值,下列叙述正确的是
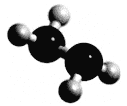
A. 32 g N2H4中含有共用电子对数为6 NA
B. 标准状况下,22.4L N2H4中含有的分子数为NA
C. N2H4和N2O4混合的总物质的量为1mol时,含氮原子数为4 NA
D. 上述反应消耗1mol N2H4,转移电子数为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
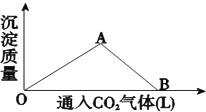
【题目】如图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后,产生 CaCO3 白色沉淀的质量与二氧化碳体积之间的关系曲线.
试回答:
OA 段所表示的反应离子方程式是:________,AB 段所表示的反应化学方程式是:________,将 B 处生成的溶液煮沸,可见到的现象是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)是三元弱酸,可以用于治疗白血病,H3AsO3水溶液中含砷物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图,下列说法正确的是
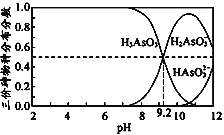
A. H3AsO3的电离方程式为:H3AsO3![]() 3H++ AsO33
3H++ AsO33
B. H3AsO3第一步的电离常数为Ka1,则Ka1=10—9.2
C. H3AsO3溶液的pH约为9.2
D. pH=12时,溶液中c(H2AsO3-) + 2c(HAsO32-) + 3c(AsO33-) + c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种晶体可表示为[MxFey(CN)z],研究表明它的结构特性是Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子晶胞结构如图所示,下列说法正确的是( )
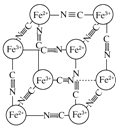
A.该晶体属于原子晶体
B.M的离子位于上述晶胞的面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com