
分析 反应SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO中,Si元素化合价降低,被还原,SiO2为氧化剂,C元素化合价升高,被氧化,C为还原剂,结合反应的化学方程式解答该题.
解答 解:反应SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO中Si元素化合价降低,被还原,SiO2为氧化剂,C元素化合价升高,被氧化,C为还原剂,由方程式可知,若反应中消耗了2mol C,则生成1mol Si,转移电子的物质的量为(2-0)×2mol=4mol.
故答案为:C;SiO2;1;4.
点评 本题考查氧化还原反应,为高考高频考点,侧重于化学与工业生产的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意从元素化合价的角度解答该题,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下表各组物质之间通过一步反应不能实现如图所示转化的是( )
下表各组物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | SO2 | SO3 | H2SO4 |
| B | NaOH | Na2CO3 | Na2SO4 |
| C | Si | SiO2 | H2SiO3 |
| D | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | NO气体遇空气由无色变为红棕色 | |
| C. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
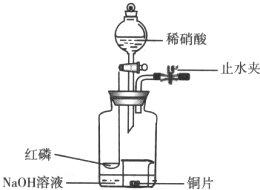 用如图示装置制备NO并验证其还原性.
用如图示装置制备NO并验证其还原性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
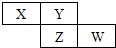 X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )
X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )| A. | Y的氢化物在常温下为液态 | |
| B. | 最高价氧化物对应水化物的酸性:W>Z | |
| C. | 最低价氢化物稳定性:Y>X | |
| D. | 原子半径:W>Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘水 | B. | 淀粉溶液 | C. | FeCl3溶液 | D. | 新制氢氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-乙基丁烷 | B. | 2-甲基丁烷 | C. | 3-甲基戊烷 | D. | 2,2-甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com