
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c(mol•L-1) | V/mL | c(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
分析 (1)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,结合电子守恒计算物质的量比;
(2)探究反应物浓度对化学反应速率的影响,由控制变量法可知,只改变浓度,其它量相同.
解答 解:(1)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,由电子守恒可知n(H2C2O4)×2×(4-3)=n(KMnO4)×(7-2),则为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5,
故答案为:≥2.5;
(2)探究反应物浓度对化学反应速率的影响,由控制变量法可知,保证其它条件不变,只改变反应物H2C2O4浓度,从而达到对照实验的目的,由总体积相同可知x=8+5-6-5=2.0,
故答案为:2.0;保证其它条件不变,只改变反应物H2C2O4浓度,从而达到对照实验的目的.
点评 本题考查探究影响反应速率的因素,为高频考点,把握电子守恒、控制变量法应用等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸呈红色的溶液中:Na+、AlO2-、NO3-、CO32- | |
| B. | 遇苯酚溶液显紫色的溶液:Na+、SO32-、S2-、Cl- | |
| C. | 含有0.1 mol•L-1 HCO3-的溶液:Na+、K+、NO3-、C6H5O- | |
| D. | 水电离出的H+浓度为1.0×10-12 mol•L-1的溶液:Na+、Fe3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:1720Cl | B. | S2-的结构示意图: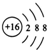 | ||
| C. | 四氯化碳的电子式: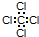 | D. | 乙醇的结构式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列给出了烃及烃的衍生物A、B、C、D、E的相关信息:
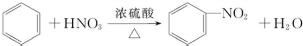
下列给出了烃及烃的衍生物A、B、C、D、E的相关信息: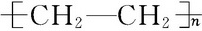 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na的原子结构示意图: | B. | NaCl的电子式:Na:Cl | ||
| C. | 乙烯的结构式:CH2=CH2 | D. | 乙醇的结构简式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com