
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是
A.当V(NaOH)=40mL时,c (Na+)+ c(H+)=2 c(A2-)+c(OH-)
B.当V(NaOH)=20mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.滴加过程中当溶液呈中性时,V(NaOH)<20mL
D.HA-的电离程度小于水解程度
【知识点】溶液中的电离、水解平衡、离子浓度大小比较
【答案解析】B 解析:A、当V(NaOH)=40 mL时,溶液恰好生成Na2A,电荷守恒:
c (Na+)+ c(H+)=2 c(A2-)+c(OH-)+ c(HA-),故A错误;B、当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,溶液呈酸性,HA-电离大于水解,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;C、当V(NaOH)=20 mL时,溶液主要为NaHA,溶液呈酸性,若要呈中性,必须V(NaOH)>20mL,故C错误;D、溶液主要为NaHA时,溶液呈酸性,HA-电离大于水解,故D错误。
故答案选B
【思路点拨】本题考查酸碱混合溶液定性判断,侧重于学生的分析能力的考查,为高考常见题型,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等。


科目:高中化学 来源: 题型:
下列实验操作:①浓硫酸的稀释②称取一定质量的NaOH固体 ③配制100ml0.1mol/l的NaCl溶液④用CCl4萃取碘水的I2⑤用自来水制取蒸馏水,一定要用到玻璃棒的是( )
A. ①②③ B. ②③④ C. ③⑤ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、
S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下:
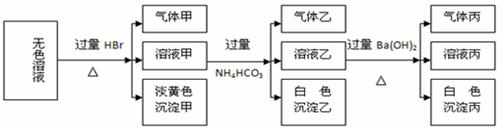
试回答下列问题:
(1)生成沉淀甲的离子方程式为: 。
(2)由溶液甲生成沉淀乙的离子方程式为 。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表(表中每一行对应正确即可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有: 。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
A.5:1 B.1:4 C.4:1 D.1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿佛加德罗常数,下列说法正确的是
A.60克SiO2含有2NA个Si-O共价键
B.1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA
C.8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA
D.NA个Fe(OH)3胶体粒子的质量为107g
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修3:物质结构】(15分)
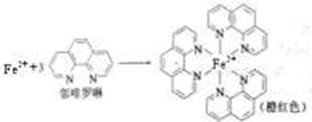 |
 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O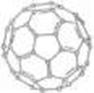
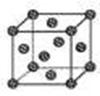
图1 图2
(4)① 有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1 mol C60分子中π键的数目为 ,C60的晶胞结构如图2,则其配位数为_______若此晶胞的密度为ρg/cm3则两个最近C60间的距离为________cm(列式表达,已知阿伏伽德罗常数为NA)
② 如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.σ键比π键的电子云重叠程度大,形成的共价键强
B.C=C双键的键能是C—C单键键能的2倍
C.s-s σ键与s-p σ键的电子云形状对称性相同
D.N2分子中有一个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是
A. 离子半径:X+>Y2+>W2->Z- B.原子半径:X>Y>W>Z
C.原子序数:Y>X>Z>W D.原子最外层电子数:Z>W>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)= 1.8×10-10,Ksp(AgY)= 1.0×10-12,Ksp(AgZ)= 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中c(Y-)= mol/L
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:
② 在上述(3)的体系中,能否实现AgY向AgX的转化?
请通过计算,简述能否实现转化的理由是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com