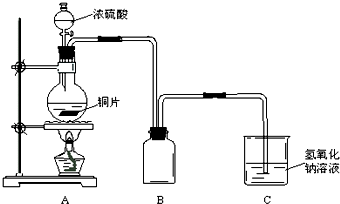
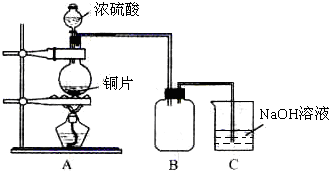
解:(1)浓硫酸和铜在加热条件下发生反应生成硫酸铜、水和二氧化硫,反应的方程式为Cu+2 H
2SO
4(浓)

CuSO
4+SO
2↑+2 H
2O;反应中浓硫酸起到酸性和氧化性的作用,
故答案为:Cu+2 H
2SO
4(浓)

CuSO
4+SO
2↑+2 H
2O;a c;
(2)二氧化硫污染空气,应用氢氧化钠溶液吸收,可在棉花上浸有NaOH溶液,故答案为:NaOH;吸收SO
2气体,防止污染空气;
(3)二氧化硫易溶于水,可观察到集气瓶内液面下降,长颈漏斗内液面上升,装置B的作用是贮存多余的气体,所盛装溶液应避免二氧化硫的溶解和发生化学反应,则应选择饱和NaHSO
3溶液,
故答案为:集气瓶内液面下降,长颈漏斗内液面上升;b;
(4)①一定质量的铜片和12ml 18mol?L
-1浓硫酸放在圆底烧瓶中共热,最后发现烧瓶中还有铜片剩余,说明一定剩余酸,这是因为浓硫酸随着反应进行,浓度变小成为稀硫酸,不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解;
故答案为:浓硫酸由浓变稀,稀硫酸不再与铜反应;
②验证剩余的稀硫酸,必须与硫酸反应且现象明显,所以加入铁粉会生成气体说明含有氢离子证明有余酸,加入氯化钡溶液会产生白色沉淀式硫酸根离子的性质,因反应生成的产物中含有硫酸铜,也可以生成白色沉淀,所以不能证明酸的存在,加入银粉不反应不能证明,加入碳酸氢钠溶液生成气体说明有气体生成是氢离子的性质可以证明有酸的存在,
故答案为:b、d;
(5)①根据反应判断:Cu+O
2=CuO 增重;Cu
2S+2O
2=2CuO+2SO
2 不变;2CuS+3O
2=2CuO+2SO
2 减重,则一定存在2CuS+3O
2
2CuO+2SO
2,
故答案为:2CuS+3O
2
2CuO+2SO
2;
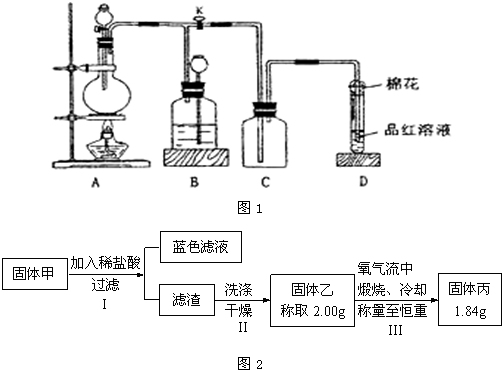
②经分析固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu
2O至少有一种.
分析反应:Cu+O
2=CuO 增重;Cu
2S+2O
2=2CuO+2SO
2 不变;2CuS+3O
2=2CuO+2SO
2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.
讨论:①若有Cu
2O,Cu
2S可有可无;
②若无Cu
2O,必有Cu
2S.
经上分析,对于固体甲的成分的判断中,正确的是acd,
故答案为:a c d.
分析:(1)浓硫酸和铜在加热条件下发生反应生成硫酸铜、水和二氧化硫;反应中浓硫酸起到酸性和氧化性的作用;
(2)二氧化硫污染空气,应用氢氧化钠溶液吸收;
(3)装置B的作用是贮存多余的气体,所盛装溶液应避免二氧化硫的溶解和发生化学反应;
(4)稀硫酸氧化性较弱,与铜不反应;
(5)固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu
2O至少有一种.
分析反应:Cu+O
2=CuO 增重;Cu
2S+2O
2=2CuO+2SO
2 不变;2CuS+3O
2=2CuO+2SO
2 减重,
故③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O
2
2CuO+2SO
2 (条件也可为“煅烧”).
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.讨论可能存在的情况可解答该题.
点评:本题整合和拓展了教材中的典型实验,侧重基本实验操作能力考查,一定要弄清楚课本中的基本实验,要通过动手做实验去了解仪器的结构、适用范围和工作原理,掌握常见气体的制备、除杂、收集、尾气处理等基本操作,熟悉教材中的典型实验装置.

 CuSO4+SO2↑+2 H2O;反应中浓硫酸起到酸性和氧化性的作用,
CuSO4+SO2↑+2 H2O;反应中浓硫酸起到酸性和氧化性的作用, CuSO4+SO2↑+2 H2O;a c;
CuSO4+SO2↑+2 H2O;a c; 2CuO+2SO2,
2CuO+2SO2, 2CuO+2SO2;
2CuO+2SO2; 2CuO+2SO2 (条件也可为“煅烧”).
2CuO+2SO2 (条件也可为“煅烧”).


 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答: 某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.
某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.