
下列离子组在一定条件下能共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的 |
A | Fe2+、NO | 稀硫酸 | 3Fe 2++NO |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-= Fe(OH)3↓ |
C | Ba2+、HCO | 氢氧化钠溶液 | H |
D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3OH-= Al(OH)3↓ |
科目:高中化学 来源:2016-2017学年山西省等三校高二上第二次联考化学试卷(解析版) 题型:选择题
下列各微粒中,能使水的电离平衡向电离方向移动.且使溶液的pH>7的是
A.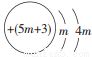 B.OH- C.Fe3+ D.HCO3-
B.OH- C.Fe3+ D.HCO3-
查看答案和解析>>
科目:高中化学 来源:2017届福建省宁德市高三上学期单科质检模拟化学试卷(解析版) 题型:选择题
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s) + 4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g) Ni(s) + 4CO(g)的平衡常数为0.5
Ni(s) + 4CO(g)的平衡常数为0.5
C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol·L-1,则此时温度高于80℃
D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江、吉林省两省六校高三上学期期中联考化学试卷(解析版) 题型:选择题
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时, a:b不可能为( )
A.3:4 B.4:5 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江、吉林省两省六校高三上学期期中联考化学试卷(解析版) 题型:选择题
①Na2CO3—制玻璃
②SiO2—太阳能电池
③干冰—人工降雨
④NaCl—制纯碱
⑤Al2O3—焊接钢轨
⑥NaClO—消毒剂
⑦Fe2O3—红色油漆或涂料
⑧MgO—耐火材料
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:实验题
味精(主要成分的化学式为C5H8NO4 Na·H2O)中往往含少量食盐,某学生想测定某品牌味精的纯度,做了如下实验:
①称取某品牌的袋装味精样品1.000 g,放入烧杯中,加入蒸馏水溶解,恢复至室温;
②在烧杯中,加入稍过量的用稀硝酸酸化的A溶液,充分反应,使沉淀完全;
③过滤,用蒸馏水反复洗涤沉淀多次;
④将沉淀烘干、称量,所得固体质量为0.368 g。
根据上述实验操作,回答下列问题:
(1)加入的A溶液是________;检验加入的A溶液是否过量的方法是_______________________。
(2)沉淀洗涤是必不可少的一步,若沉淀不洗涤,测得的结果将_____________。
(3)烘干沉淀应采用的方法是________(填字母)。
A.低温烘干 B.高温烘干 C.利用太阳能晒干
(4)该品牌味精的纯度(即味精中C5H8NO4 Na·H2O的质量分数)为__________。
(5)写出味精和食盐中都含有的元素的离子结构示意图:___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:选择题
某元素的一种同位素X的原子质量数为A,中子数为N,它与1H+组成XHm+离子,则ag XHm+中所含质子的物质的量是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:选择题
实验室里进行过滤和蒸发操作都要用到的仪器是
A. 玻璃棒 B. 烧杯 C. 蒸馏烧瓶 D. 酒精灯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二12月月考化学试卷(解析版) 题型:填空题
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________ (用离子方程式说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2 溶液中 c(NH4+)________(填“等于”、“大于”或“小于”) 0.1 mol·L-1 NH4HSO4溶液中 c(NH4+)。
(3)均为 0.1 mol·L-1 的几种电解质溶液的pH 随温度变化的曲线如图1所示。

①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填罗马数字),导致 NH4Al(SO4)2溶液的pH 随温度变化的原因是___________ 。
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中 2c(SO42-)-c(NH4+)-3c(Al3+)=___________mol·L-1。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加 0.1 mol/L的NaOH溶液,当加入NaOH溶液的体积分别为以下数据时:a、100ml b、150ml c、200ml。分析 a、b、c三种混合溶液中,水的电离程度最大的是______填(“a”、“b”或“c”);当加入NaOH溶液使溶液呈中性时,溶液中各离子浓度由大到小的排列顺序是_____ __ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com