
在100mL b mol/LAlCl3溶液中加入100mL a mol/LNaOH溶液。
(1)当a≤3b时,生成Al(OH)3的物质的量为 ![]() mol;
mol;
(2)当a、b满足 ![]() 条件时,无沉淀生成;
条件时,无沉淀生成;
(3)当a、b满足![]() 条件时,a增大,沉淀量减少,此时生成沉淀
条件时,a增大,沉淀量减少,此时生成沉淀 ![]() g。
g。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:

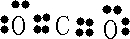
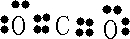
 H++Cl-+HClO
H++Cl-+HClO H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| 现象 | 结论与解释 | |
可能① |
||
可能② |
查看答案和解析>>
科目:高中化学 来源: 题型:
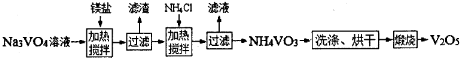
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)①C元素在周期表中的位置 , 请写出BC2分子的电子式____________。
②A元素的单质与物质甲发生反应的离子方程式___________________。
③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式。负极_________________;正极(2)A所在周期中, E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,
X、Y都是惰性电极,实验开始时,同时在两边各滴入
几滴酚酞试液,则
①电解池中Y极上的电极反应式 。
检验Y电极反应产物的方法是
②电解一段时间后,若阴极收集到112ml标准状况下的气体,
此时电解液的PH为 (假设电解液的体积保持不变,常温下)
查看答案和解析>>
科目:高中化学 来源:2012届云南省建水一中高三9月份月考理科综合试题(化学部分) 题型:填空题
(16分)四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)①C元素在周期表中的位置 , 请写出BC2分子的电子式____________。
②A元素的单质与物质甲发生反应的离子方程式___________________。
③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式。负极__________;正极(2)A所在周期中, E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,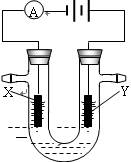
X、Y都是惰性电极,实验开始时,同时在两边各滴入
几滴酚酞试液,则
①电解池中Y极上的电极反应式 。
检验Y电极反应产物的方法是
②电解一段时间后,若阴极收集到112ml标准状况下的气体,
此时电解液的PH为 (假设电解液的体积保持不变,常温下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com