
【题目】限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐等两两相互反应,并符合离子方程式:2H++SO32-→H2O+SO2↑的化学反应个数有
A.4 B.5 C.8 D.12
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某科研小组设计出利用工业废酸(含10%的H2SO4)和废弃氧化铜锌矿制取活性ZnO的方案如图。
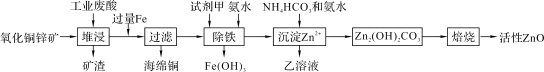
已知:298 K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在H2SO4作用下矿石中含有的ZnS溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)____Ksp(ZnS)(选填“>”、“<”或“=”)。
(2)除铁过程中试剂甲最好选用____(填序号)。
A.KMnO4 B.H2O2 C.HNO3 D.Cl2
(3)除铁过程中加入氨水的目的是调节pH在____范围之间。
(4)试写出沉淀Zn2+时发生反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ有机物A、B、C、D、E之间发生如下的转化:

(1)写出C物质的结构简式:_________________。
(2)上述②~⑧转化反应中,属于取代反应的有____________;
(3)属于加成反应的有____。(用反应序号填写)
(4)向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是______________。
请写出下列转化的化学反应方程式:
(5)B+D~E:________________________;
(6)乙烯生成聚乙烯:___________________。
Ⅱ己知葡萄糖在乳酸菌的作用下转化为乳酸,乳酸的结构简式为 。
。
试回答:
(7)乳酸分子中含有_____和_______两种官能团(写名称)。
(8)乳酸与金属钠反应的化学方程式为________________。
(9)乳酸与Na2CO3溶液反应的化学方程式为___________________________。
(10)乳酸在浓硫酸作用下,两分子相互发生酯化反应生成环状酯,此环状酯的结构简式为 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填空
(1)甲基的电子式 电石气的结构式 ___________________
(2)写出下列有机物的系统命名:CH3CH(C2H5)CH(CH3)2______
(3)写出下列各种有机物的结构简式.
①2,3﹣二甲基﹣4﹣乙基已烷 .
②支链只有一个乙基且式量最小的烷烃 .
(4)充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍.
①求该有机物的分子式 .
②该有机物链状同分异构体的结构简式为: 、 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物有广泛应用。
(1)在稀硫酸酸化的双氧水中加入二氧化锰粉末,产生大量气泡,且黑色固体消失;向反应完全后的溶液中加入高锰酸钾溶液生成黑色沉淀。经检测:1mol KMnO4完全反应转移3mol电子。在双氧水参与的反应中,二氧化锰除了作催化剂还作 ;写出加入高锰酸钾后产生黑色沉淀的离子方程式 。
(2)菱锰矿是生产铁锰合金中锰的来源,其主要成分是碳酸锰。已知锰常见的化合价有+2、+4、+6、+7。在空气中灼烧菱锰矿生产四氧化三锰,然后用铝热反应制备锰。写出菱锰矿粉末在空气中高温灼烧生成四氧化三锰的化学方程式 。如果冶炼1100kg锰,理论上消耗铝的质量为 kg。

(3)工业生产中为了制备硫酸锰,往往将硫酸锰溶液中亚铁离子氧化成铁离子,调节pH除去铁离子。向混合溶液中滴加稀硫酸酸化,加入软锰矿(主要成分是二氧化锰)氧化亚铁离子,写出该过程的离子方程式 。
(4)酸性高锰酸钾可氧化乙醇,配平下列反应方程式:
KMnO4+ H2SO4+ CH3CH2OH= K2SO4+ MnSO4+ CH3COOH+ □。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类健康或生活实际的角度考虑,下列叙述正确的是
A.用铝锅可长时间盛放酸性食物
B.氯气泄漏后应顺风向低处跑
C.食用“加碘”食盐不利于健康
D.用食醋可除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃的含氧衍生物A,能发生如下图所示的变化。在同温同压下,A蒸气的密度是H2密度的45倍,其中氧元素的质量分数为53.3%; C能使溴的四氯化碳溶液褪色,C在一定条件下转化为高分子化合物D, A中不含甲基,B不属于醚类。
已知: CH3CH2OH→CH2=CH2 + H2O

请填写下列空白:
(1)A的结构简式 C分子中的官能团名称 。
(2)C→D的反应类型是 。A→B的反应类型是 。
(3)A转化为B的化学方程式是 。
(4)3.6克A物质与足量金属钠反应生成的气体在标况的体积 升 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、
CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,
沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- (是或否)
(2)由第二份进行的实验可知混合物中应含 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是( )
A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol
B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl-
C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl-
D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表中的一部分。已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1 .5倍。
![]()
(1)B元素符号是: _______、D在元素周期表中第_______族。
(2)四种元素中原子半径最大的是(填元素符号)_______,B、C、D三种离子中半径最大的是(填离子符号)_______。
(3)B比C的氢化物的沸点高是因为_____ __;A、D两元素的气态氢化物相互反应的生成物的电子式: ,其中存在_______键、_______(填“极性”或“非极性”)共价键。
(4)写一个离子方程式证明C和D的非金属性相对强弱: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com