
����Ŀ��������װ��ͼ
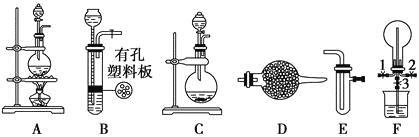
��.̽�������백���ķ�Ӧ
(1)Ϊ��ȡ���ﰱ�����ɽ�װ��C��____________(��װ�ñ��)���ӣ�װ��C�е���ƿ�ڹ�����ѡ��________________________��
a����ʯ�� b���Ȼ��� c������������ d��Ũ����
(2)װ��A��E��E���ӿ���ȡ�����������������A�з��������ӷ�Ӧ����ʽΪ��_________________��������Eװ���ڵ�ҩƷ������_________��_____________��
��.̽��ijЩ���ʵ�����
(3)����װ��A��E�������ʵ��Ƚ�Cl����Br���Ļ�ԭ��ǿ������֤�����۵�ʵ������_______________��
(4)������װ��A��E������ϩ����ˮ��Ӧ��ʵ�飬д����Ӧ�Ļ�ѧ����ʽ_________________��
(5)��װ��B��C�ֱ���F��������H2S��SO2��Ӧ��ʵ�顣F����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ________________��F���ձ������������_______________________________��
���𰸡�D a MnO2 + 4H+ + 2Cl- =����= Mn2+ + Cl2��+ 2H2O ����ʳ��ˮ Ũ���� װ��E�е�NaBr��Һ��Ⱥ� CH2=CH2��Br2�D��Br��CH2��CH2��Br SO2��2H2S=3S����2H2O ����β��
��������
��1��Ũ��ˮ����ʯ�Ҳ���Ҫ���Ȳ���������Ҫ��ȡ����Ӧ����ʢ�м�ʯ�ҵĸ���ܸ��ﰱ����
��2��ʵ���������ö������̺�Ũ������ȷ�Ӧ����������Ũ�����ӷ������ɵ������к����Ȼ����ˮ�������ñ���ʳ��ˮ��ȥ�����е��Ȼ��⣬��Ũ�����ȥ�����е�ˮ�����õ����﴿����������
��3��������������ǿ���壬�ܹ��û��壬��ˮΪ�Ⱥ�ɫ��
��4����ϩ����̼̼˫���ܹ����巢���ӳɷ�Ӧ��
��5������������������������ܹ������������������ʣ������������ⶼ�ж���Ӧ����β��������
��1��Cװ���Dz���Ҫ�����Ʊ�������װ�ã�Ũ��ˮ�Իӷ���������ʯ�Ҽ��ɲ�����������ȡ���ﰱ�������ü�ʯ�Ҹ��ﰱ����Ϊ��ȡ���ﰱ�����ɽ�װ��C����D�ĸ��ﰱ����װ�ã�װ��C�е���ƿ�ڹ�����ѡ�ü�ʯ�ң�
�ʴ�Ϊ��D��a��
��2��ʵ���������ö������̺�Ũ������ȷ�Ӧ������������Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O�����ӷ���ʽΪ��MnO2 +4H++2Cl-
MnCl2+Cl2��+2H2O�����ӷ���ʽΪ��MnO2 +4H++2Cl-![]() Mn2++Cl2��+2H2O��Ũ�����ӷ������ɵ������к����Ȼ����ˮ�������ñ���ʳ��ˮ��ȥ�����е��Ȼ��⣬��Ũ�����ȥ�����е�ˮ�����õ����﴿�����������ʴ�Ϊ��MnO2 +4H++2Cl-
Mn2++Cl2��+2H2O��Ũ�����ӷ������ɵ������к����Ȼ����ˮ�������ñ���ʳ��ˮ��ȥ�����е��Ȼ��⣬��Ũ�����ȥ�����е�ˮ�����õ����﴿�����������ʴ�Ϊ��MnO2 +4H++2Cl-![]() Mn2++Cl2��+2H2O������ʳ��ˮ��Ũ���ᡣ
Mn2++Cl2��+2H2O������ʳ��ˮ��Ũ���ᡣ
��3��װ��AΪ��ȡ������װ�ã���ȡ������ͨ�뵽ʢ�������ӵ�����Һ�У������������ӷ���������ԭ��Ӧ�����嵥�ʣ��嵥����Һˮ�γɳȺ�ɫ��Һ��
�ʴ�Ϊ��װ��E�е�NaBr��Һ��Ⱥ�ɫ��
��4����ϩ����̼̼˫���ܹ����巢���ӳɷ�Ӧ����Ӧ����ʽ��CH2=CH2+Br2��Br-CH2-CH2-Br���ʴ�Ϊ��CH2=CH2+Br2��Br-CH2-CH2-Br��
��5�������������������������ʣ�2H2S+SO2=3S��+2H2O��F�ձ�������ʣ�������������������ж���������ã��ʴ�Ϊ��SO2+2H2S=3S��+2H2O������β����


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������amol FeBr2����Һ�У�ͨ��xmol Cl2�����и���ΪͨCl2�����У���Һ�ڷ�����Ӧ�����ӷ���ʽ�����в���ȷ���ǣ�������
A. x=0.4a��2Fe2++Cl2=2Fe3++2Cl��
B. x=a��2Fe2++2Br��+2Cl2=Br2+2Fe3++4Cl��
C. x=0.6a��2Br��+Cl2=Br2+2Cl��
D. x=1.5a��2Fe2++4Br��+3Cl2=2Br2+2Fe3++6Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�ӽṹ��Ԫ�����ڱ���Ԫ���������߹�ϵ���С�
A��B��D��E��FΪԭ���������������ǰ������Ԫ�أ�����A�����������������ڲ��������2����B��D��EΪͬ����Ԫ�أ�Bԭ�ӵĺ��������������δ�ɶԵ�������5����Eԭ���������1��δ�ɶԵ��ӣ�Fԭ�Ӻ�����22���˶�״̬�ĵ��ӡ�
��ش��������⣺
��1��FԪ��λ�����ڱ�_____________������۵����Ų�ͼΪ��_____________��
��2��B��D��E����Ԫ���У���һ��������С����_____________ (��Ԫ�ط���)��д��AD2�ĵȵ�����_____________ (���Ӻ������Ӹ�дһ��)��
��3��AO2��DO2�۵�ߵ���_____________��ԭ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����������������ȷ���ǣ� ��
A. ����ֻ����̼��������Ԫ��
B. ����̼����Ԫ�ص�����һ��������
C. ����һ���DZ���������������һ��������
D. ̼ԭ�Ӽ�ֻ�Ե������ϵ���һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ���ڻ�ʱ��������H��O����������
B. ���ŵ��Ӳ��������ӣ�±����CX4���Ӽ�����������������������Ӧ���۷е�Ҳ������
C. ����H��O����H��S���ι̣�����ˮ���۷е��H2S��
D. ���ɷ��������ɵ������У����Ӽ�������Խ������Խ�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Fe(OH)2��Cu(OH)2�ı�����Һ�У����������ӵ����ʵ���Ũ�ȵĸ�����[-lgc(M2+)]����ҺpH�ı仯��ϵ��ͼ��ʾ����֪���¶���Ksp[Cu(OH)2]<Ksp[Fe(OH)2]������˵����ȷ����
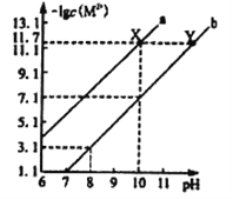
A. ����a��ʾFe(OH)2������Һ�еı仯��ϵ
B. ��ȥCuSO4��Һ�к��е�����Fe2+���ɼ�����CuO
C. ��Fe(OH)2��Cu(OH)2��������ʱ����Һ��c(Fe2+)��c(Cu2+)=104.6 ��1
D. ��X���Ӧ�ı�����Һ�м�������NaOH���壬��ת��ΪY���Ӧ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʶ�����Ư���ԣ�Ư��ԭ�����������ֲ�ͬ���ǣ� ��
A. O3 B. SO2 C. HClO D. H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��500 ����ǰ��һ��������Ȼ�մ���(Na2CO3��10H2O)���̴��ں����и�dz����Ա�DZ��ڸ�����ɳ̲���ü����մ���֧����֮�����Ǿ���ط��������մ���ɳ���Ӵ��ĵط����������ྦྷӨ���������ӡ��ش���������:
��1��ɳ̲��ɳ������Ҫ�ɷ�Ϊ_______(�ѧʽ)��
��2��������Ө���������ӿ�����______(����ĸ)��
A. ˮ������ B.��ˮ̼���� C.����� D.������
��3�����ɸ�����ʱ������Ӧ�Ļ�ѧ����ʽΪ_____________��
��4������᳣����������ʴ�̼���ԭ����______________(�û�ѧ����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2A(s)��3B(g)![]() C(g)��2D(g) ��H��0����һ���������´�ƽ�⣬�����й�������ȷ���ǣ� ��
C(g)��2D(g) ��H��0����һ���������´�ƽ�⣬�����й�������ȷ���ǣ� ��
������A������ƽ��������Ӧ�����ƶ����ڼ������B��ת������ߣ���ѹǿ����һ����ƽ�ⲻ�ƶ�����(��)����(��)���䣻������B��Ũ�ȣ���(��)����(��)���������¶ȣ�ƽ�����淴Ӧ�����ƶ�����(��)��С
A. �٢� B. �� C. �� D. �ܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com