
|
在适宜的条件下,用含有过氧化氢酶的鲜猪肝研磨液催化或氧化氢分解,比用FeCl3溶液催化过氧化氢的速度快得多,这说明与无机催化剂相比,酶具有的特性是 | |
| [ ] | |
A. |
专一性 |
B. |
多样性 |
C. |
高效性 |
D. |
适应性 |
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1| 1 |
| 2 |
| 1 |
| 2 |

| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1= CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| 4a2 |
| V2 |
| 4a2 |
| V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
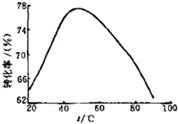
| 消耗 H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:058
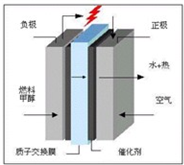
世界环保联盟将全面禁止在自来水中加氯,取而代之的是安全高效的杀菌消毒剂ClO2.
ClO2是一种黄绿色,有刺激性气味的气体,熔点:-59℃,沸点:11.0℃,它可以看作是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,少量的ClO2可用饱和草酸(H2C2O4)溶液与KClO3粉末在60℃时反应制得.甲、乙、丙三位同学分别设计了如图三套制备装置:(△代表热源,铁架台石棉网略)

(1)从甲、乙、丙三套装置中选出合理部分(按气流从左向右的方向)组装成一套较为完善的实验装置(填所选部分的编号)________.
(2)为了能使反应在适宜的条件下进行,在组装的装置中还应添加某一仪器,该仪器的名称是________.
(3)组装后的装置中的尾气吸收剂与尾气(含ClO2等气体)能发生反应,生成的主要物质(除水外)是________、________和________(写化学式).
(4)文献报道,等质量时,ClO2的消毒效果是Cl2的2.63倍,由此可判断ClO2的最终还原产物是________(用离子符号或化学式表示),推断依据是________(填计算式).
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(带解析) 题型:填空题
(10分)铁元素的化合价有+2、+3两种,磁铁矿的主要成分是Fe3O4,能与盐酸反应生成两种盐。
(1)请用铁的+2价、+3价的氧化物形式表示Fe3O4可写成___________________
(2)写出Fe3O4与盐酸反应的离子方程式_________________。
(3)设计实验验证反应后溶液中含有Fe3+所用的试剂和反应的化学方程式__________、______________。
(4)设计实验验证反应后溶液中不含Fe3+而可能含有Fe2+。进行实验操作的顺序有:①加入足量氯水,②加入足量高锰酸钾溶液,③加入少量硫氰化钾溶液,选择所需要的试剂及先后的顺序是______________(注意先后顺序)。
(5)将反应后的溶液中Fe3+全部转化为Fe2+,最适宜的物质是选用___________。
(6)将反应后的溶液中Fe2+全部转化为Fe3+,选用的绿色试剂是H2O2 ,H2O2在酸性的条件下将Fe2+氧化为Fe3+,写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高一上学期期末考试化学试卷(解析版) 题型:填空题
(10分)铁元素的化合价有+2、+3两种,磁铁矿的主要成分是Fe3O4,能与盐酸反应生成两种盐。
(1)请用铁的+2价、+3价的氧化物形式表示Fe3O4可写成___________________
(2)写出Fe3O4与盐酸反应的离子方程式_________________。
(3)设计实验验证反应后溶液中含有Fe3+所用的试剂和反应的化学方程式__________、______________。
(4)设计实验验证反应后溶液中不含Fe3+而可能含有Fe2+。进行实验操作的顺序有:①加入足量氯水,②加入足量高锰酸钾溶液,③加入少量硫氰化钾溶液,选择所需要的试剂及先后的顺序是______________(注意先后顺序)。
(5)将反应后的溶液中Fe3+全部转化为Fe2+,最适宜的物质是选用___________。
(6)将反应后的溶液中Fe2+全部转化为Fe3+,选用的绿色试剂是H2O2 ,H2O2在酸性的条件下将Fe2+氧化为Fe3+,写出反应的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com