
常温常压下,20mL某气态烃与85mL O2混合点燃并完全燃烧后恢复到原来状况,剩余气体为55mL,则此烃的化学式为 ( )
A.C2H4 B.C2H2 C.C3H6 D.C6H6
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
X、Y、Z三种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色。这三种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)X与Y在溶液中反应的离子方程式为______________________________。
(2)利用如图装置(夹持固定装置已略去)进行实验,在装置Ⅰ中加入X,装置Ⅱ中加入一种淡黄色固体物质进行反应,装置Ⅲ中生成白色沉淀,装置Ⅴ中可收集到一种无色气体。
①装置Ⅱ中反应的化学方程式为_____________________。Ⅲ的作用是 。
检验装置Ⅴ中物质的方法是____________________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的Ⅴ中的气体,所需仪器装置是________(从上图选择必要装置,填写编号)。
反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2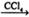 CH3CHBrCH2Br ②CH3CH2OH
CH3CHBrCH2Br ②CH3CH2OH 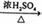 CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH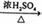 CH3COOCH2CH3+H2O ④2CH3CH2OH
CH3COOCH2CH3+H2O ④2CH3CH2OH 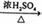 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
A. ①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是 ( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
A.①③ B.②④ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于晶体的说法中,不正确的是 ( )
①晶体中粒子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②含有金属阳离子的晶体一定是离子晶体;
③共价键可决定分子晶体的熔、沸点;
④MgO和NaCl两种晶体中, MgO的晶格能较小,所以其熔点比较低
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列;
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定;
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数不同
A.①②③ B.②③⑦
C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
 请回答下列问题:
请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)写出元素⑨的高价离子的电子排布式_____________________________。
(3)某元素的最外层电子排布式为nsnnpn+1,该元素原子的核外共有________种不同运动状态的电子。该元素在周期表中的位置是上表中相对应的 (填编号),该元素的气态氢化物沸点较高的原因是
(4)⑥、⑦分别①形成的化合物稳定性较强的为 (化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
通式为CnH2n-2的一种气态烃完全燃烧后生成CO2和H2O的物质的量之比为4:3,这种烃的链状同分异构体有( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
根据以上信息,回答下列问题:
⑴ 画出元素C的基态原子核外电子排布图: ;G元素位于周期表的 区;
B、C、D三种元素的第一电离能由大到小顺序为: (用元素符号表示)。
⑵ 化合物BA2D2蒸气293 K时,理论测算密度为2.0g·L-1,实际密度为2.5 g·L-1的原因是 。
⑶ FD2中F原子的杂化类型为 ;分子空间构型为 ;FD2易溶于水的原因可能是: (填入序号)。
①FD2与水极性相同 ②FD2可以与水反应
⑷ 有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:
查看答案和解析>>
科目:高中化学 来源: 题型:
钛合金被誉为二十一世纪的金属,具有广泛的用途。金属钛可用下列方法提炼:
① TiO2+2C+2Cl2 TiCl4+2CO ② TiCl4+2Mg
TiCl4+2CO ② TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
对上述两个反应,下列有关叙述正确的是
A.反应①中碳元素被还原 B.反应②中钛元素被氧化
C.反应①中Cl2是还原剂 D.反应②中TiCl4是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com