��2010?��̨��һģ����1������ר����Ϊ�����ý�������ˮ���е�NO
3-ת��ΪN
2���Ӷ������Ⱦ���÷�Ӧ���漰�������У�H
2O��Al��OH
-��Al��OH��
3��NO
3-��N
2���뽫�����ӷֱ��������¿ո��ڣ�������ƽ�����÷�Ӧ�����У��������뱻��ԭ��Ԫ�ص����ʵ���֮��Ϊ
5��3
5��3
��
��2���ҹ��״��ĺ������Ժ�ˮΪ�������Һ������ܷ�ӦΪ��4Al+3O
2+6H
2O=4Al��OH��
3����������ĵ缫��ӦʽΪ
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
���������ϲ����˲��������ò���Ϊ�������ŵ���
�������ȶ�����������Ӧ����״�ṹ���������������ĽӴ����
�������ȶ�����������Ӧ����״�ṹ���������������ĽӴ����
��
��3����֪��4Al��s��+3O
2��g��=2Al
2O
3��g����H=-2834.9kJ/mol
Fe
2O
3��s��+
C��s��=
CO
2��g��+2Fe��s����H=234.1kJ/mol
C��s��+O
2��g��=CO
2��g����H=-393.5kJ/mol
д�������������������ȷ�Ӧ���Ȼ�ѧ����ʽ
2Al��s��+Fe2O3��s��=2Fe��s��=2Fe��s��+Al2O3��s����H=-593.1kJ/mol
2Al��s��+Fe2O3��s��=2Fe��s��=2Fe��s��+Al2O3��s����H=-593.1kJ/mol
��
��4����һ�������������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬�õ�20mol��pH=14����Һ��Ȼ��2mol/L����ζ����ɵó������������ĵ����������ϵ����ͼ����Ӧ�����в��������������Ϊ
2.016
2.016
L����״������





 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
 ��2010?��̨��һģ��X��Y��Z��W����ͼ��ʾ��ת����ϵ����X��Y�����Ǣ�C��CO��S��SO2��AlCl3��Al��OH��3
��2010?��̨��һģ��X��Y��Z��W����ͼ��ʾ��ת����ϵ����X��Y�����Ǣ�C��CO��S��SO2��AlCl3��Al��OH��3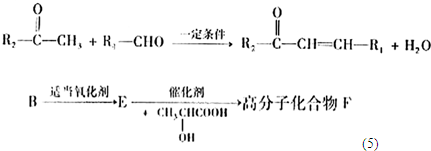
 +
+
 +H2O
+H2O +
+
 +H2O
+H2O

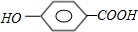 +n
+n
 +��2n-1��H2O
+��2n-1��H2O +n
+n
 +��2n-1��H2O
+��2n-1��H2O +n
+n
 +��2n-1��H2O
+��2n-1��H2O +n
+n
 +��2n-1��H2O
+��2n-1��H2O ��2010?��̨��һģ��[��ѧ�뼼��]��ҵ�Ͽ������÷����ᡢ̼������Ʊ�����ʯ��Na3AlF6�����乤�����£�
��2010?��̨��һģ��[��ѧ�뼼��]��ҵ�Ͽ������÷����ᡢ̼������Ʊ�����ʯ��Na3AlF6�����乤�����£�
 NH3?H2O+H+��HCO3-+H2O
NH3?H2O+H+��HCO3-+H2O H2CO3+OH-
H2CO3+OH- NH3?H2O+H+��HCO3-+H2O
NH3?H2O+H+��HCO3-+H2O H2CO3+OH-
H2CO3+OH-