
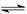 NH3·H2O+H+
NH3·H2O+H+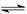 NH3·H2O+H+。
NH3·H2O+H+。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.用CO还原氧化铁来炼铁 | B.用锌和稀盐酸反应制氢气 |
| C.用稀硫酸除铁锈 | D.CO2通入澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
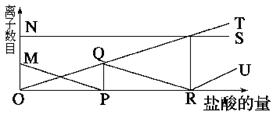
A.NS:K+; MP:H+; QR:C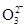 ; OT:HC ; OT:HC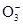 ; RU:Cl- ; RU:Cl- |
B.NS:K+; MP:C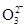 ; OQR:HC ; OQR:HC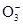 ; OT:Cl-; RU:H+ ; OT:Cl-; RU:H+ |
C.NS:K+; MP:Cl-; QR:H+; OT:HC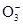 ; RU:C ; RU:C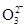 |
D.NS:K+; MP:H+; OQR:Cl-; OT:C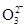 ; RU:HC ; RU:HC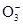 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Na+ Mg2+ Fe2+ Al3+ Fe3+ |
| 阴离子 | OH- Cl- CO32- NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KOH和Al2(SO4)3 | B.稀H2SO4和NaHCO3 |
| C.CaCl2和Na2CO3 | D.Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 所含离子 | NO3- | SO42- | H+ | Na+ | Mn+ |
| 浓度(mol/L) | 3 | 1 | 2 | 1 | A |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2溶液和K2SO4溶液反应 | B.点燃H2和Cl2的混合气体 |
| C.NaOH和CuSO4溶液 | D.Cu放入浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com