
A、 | B、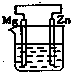 | C、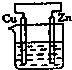 | D、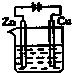 |
科目:高中化学 来源:新课标 教材全解 高中化学 配人教版(必修1) 人教版 题型:022
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省普宁市高三上学期第二次阶段考试化学试卷 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛有100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
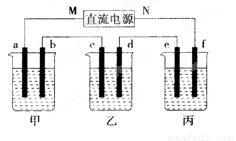
⑴接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中C电极质量增加。据此回答问题:
①电源的N断为__________极;
②电极b上发生的电极反应为________________________________________;
③电极b上生产的气体在标准状况下的体积为____________L;
④电极c质量变化是______________g ;
⑤电解前后各溶液的酸碱性大小是否发生变化,简述其原因:
甲溶液:______________________________________;
乙溶液:______________________________________;
丙溶液:______________________________________;
⑵如果电极过程中铜全部析出,此时电极能否继续进行,为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
有些化学反应的化学能能直接转化成电能
I.利用 Fe + CuSO4 = FeSO4 + Cu反应,设计一个原电池:
(1)在下框中画出装置图(标明电解质溶液、正、负极和电极材料)

(2)下列说法中,正确的是 。(填字母)
A.电解质溶液中阳离子向负极移动 B.电子通过外导线由负极流向正极
C.当导线中有1mol电子通过时,理论上正极放出1g气体
D.若所选电极的质量相等,理论上两极质量差为60g,导线中有1 mol电子通过
II.三套装置如下图所示, A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸。
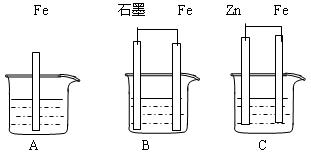
(1)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 ;
(2)若C中电解质溶液是氯化钠溶液,则Fe电极的电极反应式为 ;
III.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
![]()
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。
(1)以下说法中正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
(2)废弃的镍镉电池已成为重要的环境污染物,资料表明一节废镍镉电池可以使一平方米面积的耕地失去作用价值。在酸性土壤中这种污染特别严重,这是因为
(3)另一种常用的电池是锂电池,锂是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为Li+ MnO2 = LiMnO2。
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液(请用化学方程式表示其原因) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-―→2O2-)。
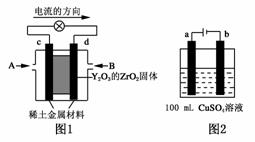
①c电极的名称为________,d电极上的电极反应式为 。
②如图2所示电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式 。若a电极产生56mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
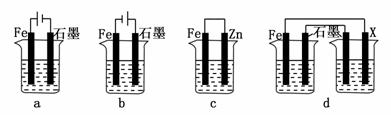
(2)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
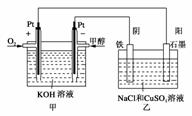
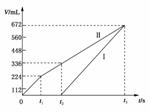
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下图:
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com