
| A. | 它们的分子数之比为1:2 | |
| B. | 它们的中子数之比为5:8 | |
| C. | 它们的电子数之比为1:2 | |
| D. | 分别与1mol钠反应,生成气体的质量比为1:1 |
分析 D2O的摩尔质量为20g/mol,重水分子中含有10个电子、10个中子;H2O的摩尔质量为18g/mol,H2O分子中含有10个电子、8个中子,然后结合n=$\frac{m}{M}$进行计算.
解答 解:A.分子数之比等于物质的量之比,则它们的分子数之比=$\frac{20g}{20g/mol}$:$\frac{36g}{18g/mol}$=1:2,故A正确;
B.1mol重水分子中含有10mol中子,2mol普通水分子中含有16mol中子,则二者含有的中子数之比为10mol:16mol=5:8,故B正确;
C.1mol重水中含有10mol电子,2mol普通水分子中含有20mol电子,则它们含有的电子数之比=10mol:20mol=1:2,故D正确;
D.1mol钠完全反应消耗1mol水分子,生成0.5mol氢气,0.5molD2的质量为2g,0.5molH2的质量为1g,生成氢气的质量之比为2:1,故D错误;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量之间的关系为解答关键,注意掌握重水与普通水分子之间的区别,试题培养了学生的分析能力及化学计算能力.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46g NO2与N2O4的混合气体含有原子总数为3NA | |
| B. | 92g甲苯中含有碳碳双键数目为3 NA | |
| C. | 1 L 1 mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| D. | 标准状况下,2.24L Cl2与水反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
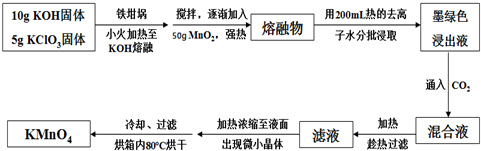
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
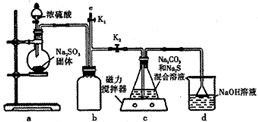 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋 | 红色很快褪为无色 | 随溶液pH减小,NaClO的氧化能力增强 |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 苯酚和水的浊液中,加Na2CO3溶液 | 溶液变澄清 | 苯酚的酸性比碳酸强 |
| D | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | 溶液X的溶质一定属于酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Mg(OH)2与盐酸的反应:OH-+H+═H2O | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com