
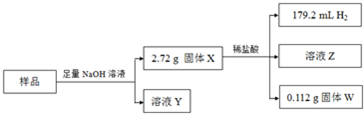
| V |
| Vm |
| 0.112 |
| 56 |
| 2.24 |
| 20 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
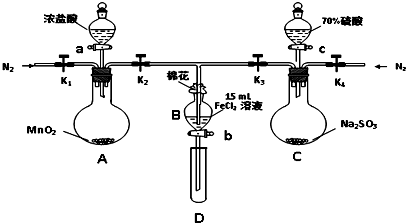
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
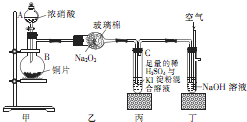 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题| 装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
| 乙 | 淡黄色固体变白色 | Na2O2+2NO2═2NaNO3 | |
| 丙 | 氧化性 |
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测溶液于试管A中,加入几滴 |
|
| 步骤② | |
|
| 步骤③ | 另取少量待测溶液于试管C中,加入足量氯水,再加入四氯化碳,静置后观察颜色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应 | A | B | C | D |
| △H/kJ?mol-1 | 10.5 | 1.80 | -126 | -11.7 |
| △S/J?mol-1?K-1 | 30.0 | -113.0 | 84.0 | -105.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处理废弃塑料制品较为合理的方法是使用化学方法把它加工成防水涂料或汽油等物质 |
| B、研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM2.5污染 |
| C、新型材料聚酯纤维、光导纤维都属于有机高分子 |
| D、工厂利用胶体电泳性质采用静电除尘工艺,可部分降低细颗粒物造成的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com