
| A. | 0.5 mol | B. | 2 mol | C. | 2.5 mol | D. | 4 mol |
分析 根据碳原子守恒计算四种有机物的物质的量,甲烷与氯气发生的取代反应:1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成HCl,可得关系式Cl2~CH3Cl,2Cl2~CH2Cl2,3Cl2~CHCl3,4Cl2~CCl4,据此计算总共消耗的氯气的物质的量.
解答 解:反应完全后,得四种有机物物质的量相等,根据碳原子守恒知,CH3Cl、CH2Cl2、CHCl3、CCl4的物质的量都是0.25mol,CH4与Cl2发生取代反应:1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成HCl,可得关系式Cl2~CH3Cl,2Cl2~CH2Cl2,3Cl2~CHCl3,4Cl2~CCl4,
生成0.25molCH3Cl需要Cl2的物质的量为0.25mol,
生成0.25molCH2Cl2需要Cl2的物质的量为0.25mol×2=0.5mol,
生成0.25molCHCl3需要Cl2的物质的量为0.25mol×3=0.75mol,
生成0.25molCCl4需要Cl2的物质的量为0.25mol×4=1mol,
所以总共消耗的氯气的物质的量n(Cl2)=(0.25+0.5+0.75+1)mol=2.5mol;
故选:C.
点评 本题考查化学方程式计算、取代反应,难度不大,注意把握氯气与甲烷发生取代反应的特征,明确取代反应中被取代的氢原子的物质的量与氯气分子的物质的量的关系是解本题的关键.


科目:高中化学 来源: 题型:解答题
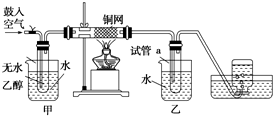 某实验如图.
某实验如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑥ | B. | ①③④⑦ | C. | ③④⑤⑥⑦ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 | |
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol H2和$\frac{1}{2}$ mol O2所具有的总能量大于1mol H2O(g)所具有的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com