
分析 (1)降低温度,平衡逆移,Cl2的转化率减小;v正减小;
(2)保持容器体积不变,加入He,对反应无影响,所以HCl的物质的量不变;
(3)保持容器压强不变,加入He,体积变大,反应物所占分压减小,平衡正移,则O2的体积分数增大;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器的体积不变,气体的总质量也不变,气体总物质的量增大,所以相对分子质量减小;
(5)加入催化剂,影响化学反应速率但不影响化学平衡,所以O2的物质的量不变.
解答 解:(1)该反应的正方向为吸热反应,所以降低温度,平衡逆移,Cl2的转化率 减小;v正减小;故答案为:减小;减小;
(2)保持容器体积不变,加入He,容器体积不变,各物质的浓度不变,所以对反应无影响,所以HCl的物质的量不变,故答案为:不变;
(3)保持容器压强不变,加入He,体积变大,反应物所占分压减小,平衡正移,则O2的体积分数增大;故答案为:增大;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器的体积不变,气体的总质量也不变,$\overline{M}$=$\frac{m}{n}$,气体总物质的量增大,所以相对分子质量减小;
故答案为:减小;
(5)加入催化剂,影响化学反应速率但不影响化学平衡,所以O2的物质的量不变,故答案为:不变.
点评 本题考查了温度、压强对化学平衡的影响,注意平衡移动对总物质的量、平均分子量的影响,掌握基础是关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Br2 | B. | CH2=CH-CH2-CH3+HCl | ||
| C. | CH3-CH=CH2+H2O | D. | nCH2=CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
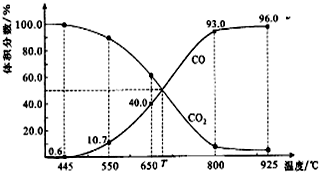
| A. | 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | Y | ||
| Z | W | M |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com