(1)一定温度下,把相对分子质量为M的可溶性盐Wg溶解在VmL水中,恰好形成饱和溶液(密度为ρg?cm-3),则溶质的质量分数为______,物质的量浓度为______,该温度下此盐的溶解度为______.
(2)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐.
①蒸发操作中使用到的仪器除铁架台(带铁圈)外,还需要仪器的名称为______.
②该同学将所得精盐配成溶液,用于另一实验.实验中需要用60mL,2mol/L的NaCl溶液,配制过程中用托盘天平称取的精盐质量为______,该同学将精盐放在天平的右盘中称量好后,配制成溶液,则该溶液的浓度______ 2mol?l-1(填“>”、“<”或“=”)
解:(1)VmL水的质量=VmL×1g/mL=Vg,
故ω(溶质)=
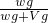
×100%=
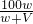
%,
溶液的物质的量浓度=
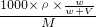
mol/L=

mol/L,
W的溶解度=
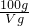
×wg=

g,
故答案为:
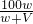
%;

mol/L;

g;
根据溶解度定义,计算100g水中溶解W的质量,即为W的溶解度.
(2)①蒸发操作中使用到的仪器除铁架台(带铁圈)、蒸发皿、玻璃棒、酒精灯,故还需要蒸发皿、玻璃棒、酒精灯,
故答案为:蒸发皿、玻璃棒、酒精灯;
据此解答;
②应选择100mL的容量瓶,需要氯化钠的质量=0.1L×2mol/L×58.5g/mol=11.7g;
将精盐放在天平的右盘中称量,实际称量氯化钠为11g-0.7g=10.3g,氯化钠的质量偏小,物质的量偏小,故配制氯化钠溶液浓度偏小,即小于2mol/L,
故答案为:11.7g;<.
分析:(1)根据m=ρV计算水的质量,再根据ω(溶质)=
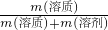
×100%计算溶液的质量分数;
根据c=
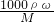
计算溶液的物质的量浓度;
根据溶解度定义,计算100g水中溶解W的质量,即为W的溶解度.
(2)①蒸发操作中使用到的仪器除铁架台(带铁圈)、蒸发皿、玻璃棒、酒精灯,据此解答;
②应选择100mL的容量瓶,根据m=cVM计算需要氯化钠的质量;
天平平衡原理为m(左盘)=m(右盘)+游码读数,据此确定清楚氯化钠的质量,根据c=

分析判断.
点评:本题考查物质的量浓度及质量分数、溶解度有关计算,物质提纯、溶液配制等,难度中等,注意对定义的理解掌握.

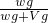 ×100%=
×100%=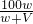 %,
%,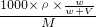 mol/L=
mol/L= mol/L,
mol/L,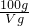 ×wg=
×wg= g,
g,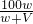 %;
%; mol/L;
mol/L; g;
g;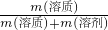 ×100%计算溶液的质量分数;
×100%计算溶液的质量分数;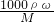 计算溶液的物质的量浓度;
计算溶液的物质的量浓度; 分析判断.
分析判断.

 3C(g),经过10min达到化学平衡,测得平衡混合气体中B的物质的量分数为25%.求:
3C(g),经过10min达到化学平衡,测得平衡混合气体中B的物质的量分数为25%.求: