
(9分) 在500mL 0.2 mol·L-1的稀硝酸中加入1.92克铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液 多少毫升?
(1)设生成的气体是X(标准状况),则
3Cu + 8HNO3=3Cu(NO3)2+4H2O+2NO↑
3×64g 8mol 2×22.4L
1.92g n(HNO3) X
所以有x=
消耗硝酸n(HNO3)=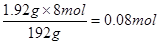
(2)原硝酸的物质的量是0.5L×0.2mol/L=0.1mol
所以剩余硝酸是0.1mol-0.08mol=0.02mol
则氢离子的浓度是0.02mol÷0.5L=0.04mol/L
(3)根据铜原子守恒可知,生成硝酸铜是1.92g÷64g/mol=0.03mol
因此反应后的溶液中含有0.02mol硝酸和0.03mol硝酸铜
所以要使溶液中的Cu2+全部转化为Cu(OH)2沉淀
需要氢氧化钠的物质的量是0.02mol+0.03mol×2=0.08mol
体积是0.08mol÷0.2mol/L=0.4L=400ml
解析


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2011-2012学年安徽省六安三中高一下学期期末考试化学B卷(带解析) 题型:实验题
(9分)在室温下,将表面积相同、纯度相同、体积也相同的同种锌片分别投入lOOmL、O.1mol/L的稀硫酸和0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异,投入到稀硫酸中的锌表面产生的气泡没有投人到稀盐酸中的快。大家分析、讨论后认为产生这一现象的原因可能有两个:氯离子对反应起了正的催化作用,即氯离子加快了反应;
另一种可能是硫酸根离子对反应起了负催化作用,即硫酸根离子阻碍了反应的进行。持前一种观点的三位同学设计实验并根据实验现象认为均证实了自己的推论是正确的,他们的实验方案和实验现象分别是:
甲:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投人lOOmL0.1mol/L的稀硫酸中,并加入适量氯化钠固体,发现反应速率加快;
乙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投入lOOmLO.1mol/L的稀硫酸中,并加入适量氯化锌固体,发现反应速率加快;
丙:在室温下,将表面积相同、纯度相同、体积也相同的同种锌片投人lOOmLO.1moL/L的稀硫酸中,并加入适量氯化钡固体,发现反应速率加快;
请你对三位同学的实验方案作出评价,他们能否得出“氯离子对反应起了正的催化作用”的结论,并简要说出弹由.
甲:________;____________________________________________________________
乙:________;____________________________________________________________
丙:________;____________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省高安中学高一上学期期中考试化学试卷 题型:填空题
(9分)①在进行过滤操作时,需用到的玻璃仪器是
②在进行分液和配制物质的量浓度溶液时,首先要分别对分液漏斗、容量瓶进行 .
③用一种试剂除去NaCl溶液中含有的CuCl2,写出所用试剂及反应的离子方程式
除杂试剂: (写化学式) 离子方程式:
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高一下学期期中素质测试化学试卷(解析版) 题型:计算题
(9分) 在500mL 0.2 mol·L-1的稀硝酸中加入1.92克铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液 多少毫升?
查看答案和解析>>
科目:高中化学 来源:2012届广西桂林中学高二下学期期中考试化学试卷 题型:填空题
(9分)在某有机物A的结构简式如图

(1)A与NaOH溶液反应的化学方程式是
(2)A与NaHCO3溶液反应的化学方程式是
(3) A在一定条件下跟Na反应的化学方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com