
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数的值用NA表示,气体摩尔体积用Vm表示则:
(1)该气体的物质的量为________。
(2)该气体所含分子数为________。
(3)该气体所含原子总数为________。
(4)该气体在标准状况下的体积为________。
 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制1 molL﹣1的NaOH溶液450 mL。请回答下列问题:
(1)计算:需要称取NaOH固体__g。
(2)配制时,必须使用的仪器有托盘天平(带砝码)、药匙、烧杯、玻璃棒、量简,还缺少的仪器是__、__。(填仪器名称)
(3)在使用容量瓶前必须进行的一步操作是__。
(4)实验两次用到玻璃棒,其作用分别是:先用于__、后用于__。
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是__(填字母)。
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.天平砝码生锈
C.配制过程中遗漏了洗涤步骤
D.未冷却到室温就注入容量瓶
E.加蒸馏水时不慎超过了刻度线
F.定容观察液面时俯视
(6)若实验过程中出现(5)中D这种情况你将如何处理?__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
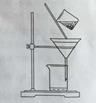
a. 漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
CaCO![]() 滤液
滤液![]()
![]() 白色晶体
白色晶体
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4— (绿色)、Cr2O72— (橙红色)、CrO42— (黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_____。
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应__________。
②由图可知,溶液酸性增大,CrO42-的平衡转化率____(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为_____。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可划分为一次能源和- 二次能源,直接从自然界取得的能源称为一级能源,一次能源经过加工、转换得到的能源成为:二次能源。下列能源中属于一次能源的是
A. 氢能B. 电能C. 核能D. 水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2,4KO2+4CO2+2H2O→4KHCO3+3O2,若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少_______?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2,已知:CO+2H2
CO+3H2,已知:CO+2H2![]() CH3OH,CO2+3H2
CH3OH,CO2+3H2![]() CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______。
CH3OH+H2O。300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6mol电子,则有1molCr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为H2C2O4![]() CO↑+CO2↑+H2O。某学习小组设计实验探究CO还原氧化铅并检验氧化产物的装置如图所示(已知CO通入银氨溶液产生黑色银粒)。下列说法正确的是
CO↑+CO2↑+H2O。某学习小组设计实验探究CO还原氧化铅并检验氧化产物的装置如图所示(已知CO通入银氨溶液产生黑色银粒)。下列说法正确的是

A. 装置②③⑤⑥中的试剂依次为氢氧化钠溶液、碱石灰、银氨溶液、澄清石灰水
B. 实验时,先点燃①处酒精灯,等装置⑥中有明显现象且有连续气泡后再点燃④处酒精灯
C. 实验完毕时,先熄灭①处酒精灯,再熄灭④处酒精灯
D. 尾气处理装置可选用盛NaOH溶液的洗气瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com