
【题目】少量的金属钠长期暴露在空气中,它的最终产物是( )
A.Na2O2B.NaHCO3C.Na2CO3D.Na2CO3·10H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做制冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)![]() CH3OH(g)△H=-90.0kJ·mol-1①
CH3OH(g)△H=-90.0kJ·mol-1①
2CH3OH(g)![]() CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.1kJ·mol-1③
CO2(g)+H2(g)△H=-41.1kJ·mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO![]() CH3OCH3+CO2的热化学方程式为____________________。
CH3OCH3+CO2的热化学方程式为____________________。
(2)已知一些共价键的键能如下:
化学键 | H-H | C-H | C-O | O-H |
键能(kJ·mol-1) | 436 | 414 | 326 | 464 |
运用反应①计算一氧化碳中碳氧共价键的键能____________kJmol-1。
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是

A. 点a的正反应速率比点b的小
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
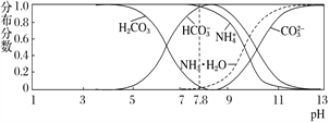
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )。
A. 氧化→吸收→吹出B. 氧化→吹出→吸收
C. 吹出→氧化→吸收D. 吹出→吸收→氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
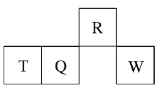
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 单质T与NaOH溶液不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:
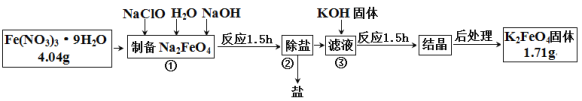
回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐除NaNO3 外,还有 ____________(填化学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4 _____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为__________________。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸入一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。如果标况下产生气体2.24L,则参加反应的FeO42- 数目_____________;K2FeO4作为净水剂的优点除铁无毒,能消毒杀菌外还有__________________________________。
(6)某同学设计以下两个实验探究高铁酸钾的稳定性。
(实验1)将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0mmolL-1(1mmolL-1=10-3molL-1)的试样,静置,结果见图1。
(实验2)将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为1.0mmolL-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,结果见图2。
(实验结论)根据图一,可以得出的结论是:________________________________________
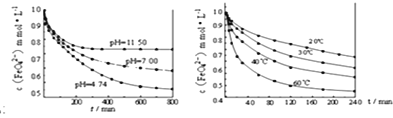
图1 图2
(7)常温下,某水溶液含有Fe3+,Cu2+,调节溶液pH=10时,两种氢氧化物沉淀共存,已知该温度下, Ksp(Fe(OH)3)= a, Ksp(Cu(OH)2)= b,则溶液中C(Fe3+)/C(Cu2+)=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com