
 SO42-+
SO42-+ Ba2++(n+m)OH-=
Ba2++(n+m)OH-= BaSO4↓+nNH3?H2O+mH2O,其中n<m;
BaSO4↓+nNH3?H2O+mH2O,其中n<m; ,符合实际反应,故D正确;
,符合实际反应,故D正确;

 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2012-2013学年江苏省苏南四校高三12月月考试化学试卷(解析版) 题型:填空题
(12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:
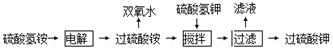
(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式
②写出水解器中(NH4)2S2O8溶液的水解方程式 。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因 。
④试分析水解器中使用减压水解、蒸馏的原因 。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为 。
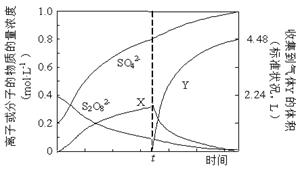
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com