
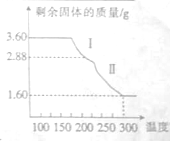
 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛.
| ||
| 56 |
| 180 |
| 1.12g |
| 56g/mol |
| 0.48g |
| 16g/mol |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l) 2H2(g)+O2(g)=2H2O(g) | ||||
B、H2(g)+Cl2(g)=2HCl(g)
| ||||
C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) NaOH(aq)+
| ||||
D、C(s)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
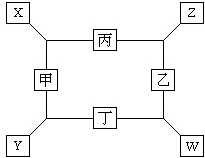 如图所示,已知:
如图所示,已知:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 21.98 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 22.02 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
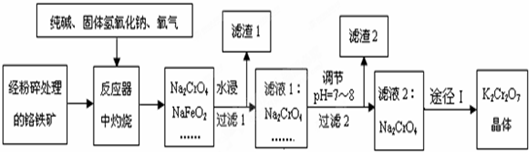
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)<c(OH-)的溶液中,Na+、K+、SO42-、ClO- |
| B、能使酚酞变红的溶液中:Na+、Cu2+、CO32-、NO3- |
| C、0.1mol?L-1FeCl3溶液中:K+、NH4-、I-、SCN- |
| D、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com