
【题目】在某2 L恒容密团容器中充入2 mol X(g)和1mol Y(g)发生反应:2X(g)+ Y(g)![]() 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是( )
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是( )

A.Q点时,Y的转化率最大
B.升高温度,平衡常数增大
C.W点Y的正反应速率等于M点Y的正反应速率
D.平衡时充入Y,达到新平衡时Y的体积分数比原平衡时小
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在漂白液(次氯酸钠溶液)中:Ag+、K+、NO3-、SO32-
B.中性溶液:K+、NO3-、Br-、Fe3+
C.![]() =1012的溶液中,NH4+、Ca2+、Cl-、NO3-
=1012的溶液中,NH4+、Ca2+、Cl-、NO3-
D.由水电离的c(H+)=1×10-10mol/L的溶液中:K+、Na+、HCO3-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL一定浓度的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )

A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点的pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
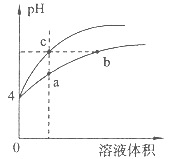
A. a、c两点溶液的导电能力相同
B. b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C. a、b、c三点溶液中水的电离程度a>b>c
D. 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
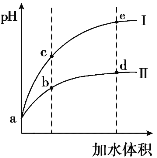
A.曲线II代表HCl的稀释过程
B.溶液中水的电离程度:b点>c点
C.从b点到d点,溶液中![]() 保持不变
保持不变
D.该温度下,b点Kw的数值比e点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
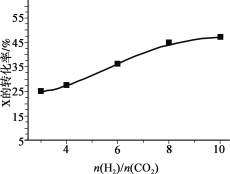
① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,关于该有机物的下列叙述不正确的是( )
![]()
A.不能使酸性 KMnO4溶液褪色
B.在一定条件下能发生消去反应
C.在一定条件下,1mol 该有机物最多能与 4molH2反应
D.可能是某高聚物的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是________?
(2)已知Ksp[Mg(OH)2]=1.8×10-11,则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH为________?
(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是________?当Mg2+完全沉淀时,溶液的pH为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46kJ的热量,表示该反应的中和热的热化学方程式为
A.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46 kJ·mol-1
C.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
D.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-114.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com