
| A、a瓶中含有的溶质HCl比b瓶的多 |
| B、将b瓶加水稀释为原来体积的2倍,盐酸的物质的量浓度不变 |
| C、从b瓶中取出十分之一溶液,溶质HCl的物质的量变为0.2 mol |
| D、a瓶盐酸的物质的量浓度因未知溶液的密度无法计算 |
| 1 |
| 2 |
| 1000ρω |
| M |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、所有自发进行的化学反应都是放热反应 |
| B、熵减小的化学反应不能自发进行 |
| C、气体分子总数增多的反应是熵增大的反应 |
| D、同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用丁达尔效应可以鉴别氯化铁溶液和氢氧化铁胶体 |
| B、明矾能净水,是因为溶于水能形成胶体,吸附性强 |
| C、胶体静置片刻后会出现分层现象 |
| D、胶体、溶液和浊液的本质区别是分散质粒子的大小不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在密闭容器中加入1mol N2和3mol H2,一定条件下充反应生成NH3分子数小于2NA |
| C、将0.1mol FeCl3溶于1L水中,所得溶液含有0.1NA个Fe3+ |
| D、1L 1mol/L的KF溶液中含有F-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为1 mol/L的K2SO4溶液中,含2 NA个K+ |
| B、把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol?L-1 |
| C、常温常压下,71 g Cl2含有2 NA个Cl原子 |
| D、标准状况下,11.2 L 氦气中含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
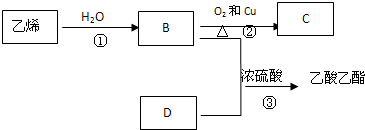
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com