
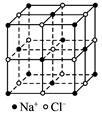
科目:高中化学 来源:不详 题型:单选题
A.碳酸氢根离子的电离方程式: HCO3-+H2O H3O++ CO32- H3O++ CO32- |
| B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱 |
| C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S |
| D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.冰熔化时,分子中H-O键发生断裂 |
| B.原子晶体中,共价键越强,熔点越高 |
| C.分子晶体中,共价键键能越大,该分子晶体的熔点越高 |
| D.分子晶体中,分子间作用力越大,则分子越稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在氯化钠晶体中,只有阴离子和阳离子,没有NaCl分子 |
| B.在氯化钠晶体中存在NaCl分子 |
| C.石英是由SiO2形成的分子晶体 |
| D.金刚石和石墨晶体都是由碳原子网状结构形成的典型的原子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li>Na>K>Rb>Cs | B.NaCl>KCl>RbCl>CsCl |
| C.F2>Cl2>Br2>I2 | D.金刚石>硅>碳化硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.全部由非金属元素形成的化合物中只含有共价键 |
| B.分子晶体的熔点较低,因为分子晶体中有化学键 |
| C.金属在常温下都以晶体形成存在 |
| D.金属晶体中,自由电子几乎均匀分布在整个晶体中,被许多金属离子共用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔沸点:单晶硅>碳化硅>金刚石 | B.熔沸点:MgO>NaCl>KCl |
| C.熔沸点:Na>Mg>Al | D.熔沸点:O2>I2>Hg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | 表述1 | 表述2 | ||
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |