
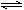 2NO+O2�ں����ܱ������з�Ӧ����˵����Ӧ�Ѵﵽƽ��״̬����
2NO+O2�ں����ܱ������з�Ӧ����˵����Ӧ�Ѵﵽƽ��״̬���� | A���٢ۢ� | B���ڢܢݢ� | C���٢ۢܢݢ� | D���٢ڢۢܢݢ� |
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������H��0����S��0���κ��¶��¶����Է����� |
| B������H��0����S��0���κ��¶��¶������Է����� |
| C������H��0����S��0������ʱ���Է����� |
| D������H��0����S��0������ʱ���Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2C(g)
2C(g) 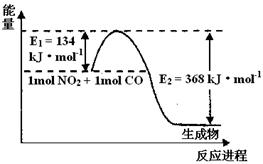
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3��ƽ�⣬��û��������N2��H2��NH3�����ֱ�Ϊm��n��gmol�����¶Ȳ��䣬ֻ�ı��ʼ���ʵļ���������Ҫ��m��n��g�ܱ��ֲ��䡣��N2��H2��NH3����ʼ��������x��y��z��ʾʱ��Ӧ����������
2NH3��ƽ�⣬��û��������N2��H2��NH3�����ֱ�Ϊm��n��gmol�����¶Ȳ��䣬ֻ�ı��ʼ���ʵļ���������Ҫ��m��n��g�ܱ��ֲ��䡣��N2��H2��NH3����ʼ��������x��y��z��ʾʱ��Ӧ�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
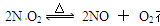 ������̶����ܱ������У����������жϸ÷�Ӧ����ƽ��״̬����
������̶����ܱ������У����������жϸ÷�Ӧ����ƽ��״̬����| A����λʱ���ڣ�����n mol O2��ͬʱ����2n mol NO2 |
| B����λʱ���ڣ�����n mol O2��ͬʱ����2n mol NO |
| C��ijʱ��NO2��NO��O2�����ʵ���Ũ��֮��Ϊ2��2��1 |
| D������������ɫ���ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g�� ��H<0��ƽ��ʱC������������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
2C��g�� ��H<0��ƽ��ʱC������������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H��0����H-T��S��0 | B����H ��0����H-T��S��0 |
| C����H��0����H-T��S��0 | D����H ��0����H-T��S��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͬһ�����£���ͬ���ʵ���Ũ�ȵİ�ˮ�ĵ���̶�����ͬ�� |
| B��ǿ����ʶ������ӻ����������ʶ��ǹ��ۻ����� |
| C����Ӧ�ܷ��Է��������¶��й� |
| D�����Է����еĻ�ѧ��Ӧ��һ���ǡ�H>0����S>0 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com