
����Ŀ����һ������SO2�ͺ�1molO2�Ŀ����������������������壩����2L�ĺ����ܱ������У�ij�¶�ʱ���ڴ��������·�����Ӧ��2SO2��g��+O2 ��g�� ![]() 2SO3 ��g����H��0����Ӧ�ﵽƽ��������еĻ������ͨ������NaOH��Һ�����������1.8mol���ٽ�ʣ������ͨ��ij��Һ����O2 �� �����ּ�����0.2mol����ش��������⣺
2SO3 ��g����H��0����Ӧ�ﵽƽ��������еĻ������ͨ������NaOH��Һ�����������1.8mol���ٽ�ʣ������ͨ��ij��Һ����O2 �� �����ּ�����0.2mol����ش��������⣺
��1���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��������ĸ���� a�������л��������ܶȱ��ֲ��� b��SO2����������ֲ���
c�������������ѹǿ���� d��SO3������������SO2�������������
��2�������SO2��ת���ʣ����д�ʩ���е���������ĸ���� a�����������ٳ���N2 b�����������ٳ���O2
c���ı䷴Ӧ�Ĵ��� d�������¶�
��3�������¶ȣ�������Ӧ��ƽ�ⳣ��K���������С�����䡱����ͬ������ѧ��Ӧ���� ��
��4�����¶��£���Ӧ2SO2 ��g��+O2 ��g��2SO3��g����ƽ�ⳣ��K= ��
���𰸡�
��1��bc
��2��bd
��3����������
��4��640
���������⣺��1��a�����������غ㶨�ɣ����ҷ�Ӧǰ������������䣬�ʻ��������ܶȱ��ֲ��䣬����˵������ƽ��״̬����a���� b�����淴Ӧ�ﵽƽ��״̬ʱ��SO2����������ֲ��䣬��SO2��Ũ�ȱ��ֲ��䣬˵������ƽ��״̬����b��ȷ��
c���淴Ӧ������������ʵ�����С�����º����£�����������ѹǿ��С���������������ѹǿ���䣬˵������ƽ��״̬����c��ȷ��
d��SO3������������SO2���������ʶ���ʾ����Ӧ���ʣ���Ӧʼ�ն��߶���1��1���У�����˵������ƽ��״̬����d����
���Դ��ǣ�bc�� ��2��a����װ�����ٳ���N2 �� ��Ӧ����������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ������Բ������ת���ʣ���a����
b����װ�����ٳ���O2 �� ����Ũ������ƽ��������Ӧ�����ƶ�������˶��������ת���ʣ���b��ȷ��
c���ı䷴Ӧ�Ĵ���ֻ�ı䷴Ӧ���ʣ����ı�ƽ�⣬���Բ�����߶��������ת���ʣ���c����
d�������¶ȣ�ƽ�����淴Ӧ�����ƶ��������˶��������ת���ʣ���d��ȷ��
���Դ��ǣ�bd�� ��3��k= ![]() �������¶ȣ�ƽ�����淴Ӧ�����ƶ�����K��С�������¶ȣ���ѧ��Ӧ���ʼӿ죻
�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����K��С�������¶ȣ���ѧ��Ӧ���ʼӿ죻
���Դ��ǣ���С������4����O2 �� �����ּ�����0.2mol����ƽ��ʱ������Ũ��Ϊ ![]() =0.1mol/L���������仯�� 0.4mol/L�������������������Ũ�ȱ仯Ϊ 0.8mol/L
=0.1mol/L���������仯�� 0.4mol/L�������������������Ũ�ȱ仯Ϊ 0.8mol/L
��0.8mol/L����ƽ��ʱSO3Ũ��Ϊ 0.8mol/L���������еĻ������ͨ������NaOH��Һ�����������1.8mol����0.9mol/L����ƽ��ʱSO2Ũ��Ϊ 0.1mol/L��
2SO2 ��g��+ | O2 ��g�� | 2SO3��g�� | |
��ʼ | 0.9 | 0.5 | 0 |
ת�� | 00.8 | 0.4 | 0.8 |
ƽ�� | 0.1 | 0.1 | 0.8 |
k= ![]() =
= ![]() =640��
=640��
���Դ��ǣ�640��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ж�(״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y����)����Ҫ���ջ�ѧƽ��ļ���(��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%)�����֪ʶ���Ǵ���Ĺؼ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ輰�仯����������У�����ȷ����
A.ˮ��������ճ�ϼ����ͻ����B.������뵼�����
C.���������ǹ��ά��ԭ��D.�������մ���������Ԫ���IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦC��s��+H2O��g��H2��g��+CO��g������H��0�ﵽƽ��ı�ijһ������������ı����ʵ����������£�����Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ�� 
��ͼ��t2��t3�Ρ�t4��t6��ʱ����ƽ���ƶ��������ֱ����������
��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪ 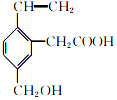 ������˵����ȷ���ǣ� ��
������˵����ȷ���ǣ� ��
A.�����ʵķ���ʽΪC11H10O3
B.���л��ﺬ��4�ֹ�����
C.1 mol���������������2 mol NaOH
D.���л��ﲻ�ܷ�����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�HA�ĵ���ƽ�ⳣ��Ka=6.25��10��5 �� H2CO3�ĵ���ƽ�ⳣ��Ka1=4.17��10��7��Ka2=4.90��10 ��11 �� ������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壮����˵������ȷ���ǣ������������������ɷ֣��� �� A����ͬ���ʵ���Ũ�ȵ�Na
A.HA�����Һ�ʼ���
B.���CO2����ѹ����̼��������c ��A������С
C.��̼�����ϵ�pHΪ5.0ʱ�� ![]() =0.16
=0.16
D.̼�������и����ӵ�Ũ�ȹ�ϵΪc�� H+��=c�� HCO3����+2c�� CO32����+c��OH������c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ã�����ͨ������X���ɿ���a���к�ɫ�������ɣ�b��������c���õ�Һ�壬������X������(����)
A.H2
B.CO��H2
C.NH3
D.CH3CH2OH(����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йش����Ĵ�����������ɴӡ��Ҵ�������ʵ�顱�õ�һЩ��ʶ����ʵ��װ����ͼ��ʾ��
ʵ�������Ԥ��ʹ���Ž��Ҵ�����ͼ��װ�ã���ͭ˿���м䲿�ּ��ȣ�Ƭ�̺�ʼ�н���(��Ъ��)�ع�����������ɹ۲쵽���Ե�ʵ��������ش��������⣺
��1�������ȵ�ͭ˿��������Ӧ�Ļ�ѧ����ʽΪ��
��2��A���пɹ۲쵽����
���п���ʶ���ڸ�ʵ������д����������ʱ�μ��˻�ѧ��Ӧ��������ʶ�������������ʱ��Ҫһ������
��3��ʵ��һ��ʱ�����������ƾ��ƣ���Ӧ(��ܡ����ܡ�)�������С�ԭ���ȵ�ͭ˿���������� �� ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��8g CH4����mol��ԭ�ӣ�0.1mol NH3����Լ��ԭ�ӣ�ͬ��ͬѹ�£�ͬ�����NH3��H2S�����������Ϊ��ͬ��ͬѹ�£�ͬ������NH3��H2S����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�����ҺA��μ������B�У�����������ȷ���ǣ� �� 
A.��AΪŨ���ᣬBΪMnO2 �� C��ʢƷ����Һ����C����Һ����ɫ
B.��AΪ���ᣬBΪ���ǣ�C��ʢ��������ʯ��ˮ����C����Һ�����
C.��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢAlCl3��Һ����C���Ȳ�����ɫ��������������ܽ�
D.��AΪŨ���ᣬBΪNa2SO3���壬C��ʢʯ����Һ����C����Һ�ȱ�����ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com