

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 122 | 216 | 311 | 440 | 585 | 733 |
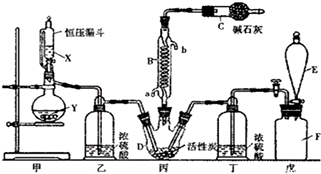
分析 由制备AgN03的工艺流程图可知,Cu、Ag均与浓硝酸反应,生成气体甲为二氧化氮,溶液I中含AgNO3和Cu(NO3)2,结晶得到固体混合物A中含AgNO3和Cu(NO3)2,结合表格中的分解温度可知,控制温度为473-673K时Cu(NO3)2分解生成CuO,则固体B中含CuO、AgNO3,溶于水过滤得到D为CuO,溶液II中含AgNO3,蒸发浓缩、冷却结晶析出晶体,以此来解答.
解答 解:由制备AgN03的工艺流程图可知,Cu、Ag均与浓硝酸反应,生成气体甲为二氧化氮,溶液I中含AgNO3和Cu(NO3)2,结晶得到固体混合物A中含AgNO3和Cu(NO3)2,结合表格中的分解温度可知,控制温度为473-673K时Cu(NO3)2分解生成CuO,则固体B中含CuO、AgNO3,溶于水过滤得到D为CuO,溶液II中含AgNO3,蒸发浓缩、冷却结晶析出晶体,
(1)由上述分析可知,黑色固体D为Cu(NO3)2分解生成的CuO;①加热温度应控制在能使Cu(NO3)2分解而不使AgNO3分解的范围,根据二者的分解温度,故选择473-673K,
故答案为:CuO;473-673K;
(2)由AgNO3的溶解度表可知,AgNO3的溶解度受温度影响较大,适宜采用冷却热饱和溶液的方法从溶液II中获得纯净AgNO3晶体,主要操作包括蒸发浓缩→冷却结晶→过滤→洗涤→干燥,
故答案为:蒸发浓缩;冷却结晶;过滤;
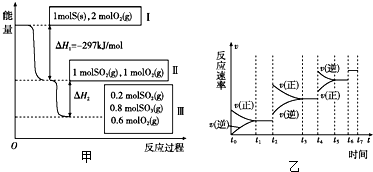
(3)常温下将0.1 mol•L-1 NaOH溶液与0.2 mol•L-1 HNO2等体积混合后溶液中含有相同物质的量的HNO2与NaNO2,由于常温时Ka(HNO2)=4.9×10-4,故Kh(NO2-)=2.0×10-11,即该溶液中HNO2的电离程度大于NaNO2的水解程度,此时溶液呈酸性,所以溶液中离子浓度由大到小为c(NO2-)>c (Na+)>c (H+)>c (OH-),
故答案为:c(NO2-)>c (Na+)>c (H+)>c (OH-);
(4)含有Cu2+的AgNO3溶液中加入某固体充分反应后可使Cu2+生成蓝色沉淀Cu(OH)2,为提高溶液pH值使得Cu2+生成沉淀且不引入新的杂质,该固体应为Ag2O,
故答案为:D;
(5)根据Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.2×10-12,向含有Cl-和CrO42-的溶液中逐滴加入AgNO3时,Cl-先生成沉淀,当滴入最后一滴AgNO3后,有砖红色沉淀生成.K2CrO4溶液为黄色,浓度过大使得溶液呈黄色,将影响对滴定终点现象的判断(另K2CrO4溶液浓度过大时,有可能会在Cl-未完全沉淀时与Ag+结合,对滴定终点判断造成误差),
故答案为:当滴入最后一滴AgNO3后有砖红色沉淀生成;K2CrO4溶液为黄色,浓度过大将影响滴定终点现象的判断(或K2CrO4溶液浓度过大时,有可能会在Cl-未完全沉淀时与Ag+结合,对滴定结果造成误差).
点评 本题考查物质的制备实验,为高频考点,涉及制备流程、物质的性质、离子浓度大小比较急Ksp运用等,综合性较强,侧重分析与实验能力的综合考查,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴加足量盐酸无规象,再滴加BaCl2溶液有白色沉淀.则原溶液中有SO42- | |
| C. | 某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ | |
| D. | 某溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀镍时,Ni为阴极,镀件为阳极 | |
| B. | 电镀和化学镀原理都是利用氧化还原反应 | |
| C. | 化学镀无需通电,对镀件的导电性无特殊要求 | |
| D. | 化学镀中H2PO2-中P化合价为+1,有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、NO3- | B. | Na+、K+、SO32-、CO32- | ||
| C. | K+、HCO3-、NO3-、Cl- | D. | Ca2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com