
| V |
| Vm |
| ||
| 5.6L |
| 22.4L/mol |
| ||
| 21.75g |
| 25g |


科目:高中化学 来源: 题型:
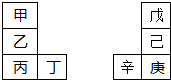 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
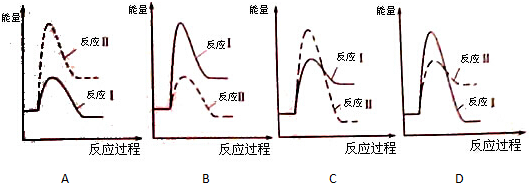
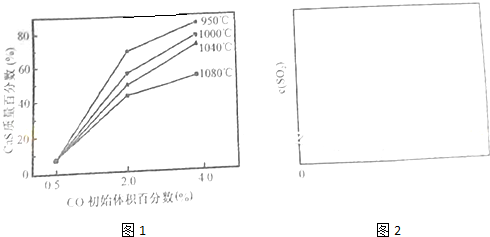
查看答案和解析>>
科目:高中化学 来源: 题型:
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
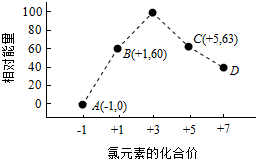
查看答案和解析>>
科目:高中化学 来源: 题型:

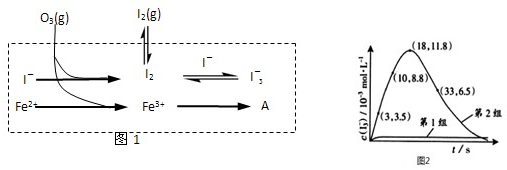
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
| 开始沉淀pH | 完全沉淀pH | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.87 | 3.87 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.
鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有③ | B、②③ | C、①③ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com